我们都见过蜘蛛网,蜘蛛网是由蜘蛛吐丝形成的,无论什么飞虫,一旦撞上便很难逃走。据报道,组成蜘蛛网的蛛丝是钢的五倍,已被美国军方考虑生产防弹衣的材料。自然形成的蜘蛛丝中是一种基于天然多肽的结构,其优异的力学性归因于多肽内氨基酸的空间排列,通过以疏水氨基酸残基(即丙氨酸)为主的氢键排列形成高阶β-折叠结构。围绕这些β-折叠结构的是一种半非晶态、高度可延伸的富含甘氨酸区域的排列,特殊的排列方式(成分和空间)使得蜘蛛丝显示出难以置信的韧性——拉伸强度在0.88–1.5 GPa之间,断裂伸长率为21–27%。这种不可思议的机械潜力引起了人们对多肽在合成材料(如水凝胶、薄膜和纤维)中的广泛应用的极大兴趣,其中包括组织工程和药物传递。
在合成β-折叠形成肽时,无论是合成工艺还是分子组成都需要慎重考虑。通过转基因微生物合成和固态合成都是生产肽的常用方法,但前者需要对肽序列的基因来源有敏锐的认识,后者则仅限于制备短链肽。N-羧基环内酸酐开环聚合(NCA ROP)是一种较为廉价和简单的合成大量多肽的方法,具有更大的潜力来产生长链多肽。在设计β-折叠形成的多肽时,疏水缔合的控制是基本的,但在实验室很难实现。这通常会导致不明确、不受控制且不易溶解的聚集体,极大地影响所形成结构(例如体相水凝胶)的机械潜力。
一般来说,通常用于缓解疏水残基不受控制的缔合和不可用聚集体的尝试是引入了高比例的亲水组分形成多肽,在随后的将肽并入水凝胶中采用grafting-to法,但由于疏水缔合的破坏,加入它们对多肽的机械潜力极为不利。天然蜘蛛丝在天然丝纤维生产过程中使用丙氨酸模块形成β折叠,这涉及到特定的环境变化以促进β折叠的形成。然而,丙氨酸在低分子量(小模块)下形成β折叠,但高分子量(大模块)下则形成α螺旋。
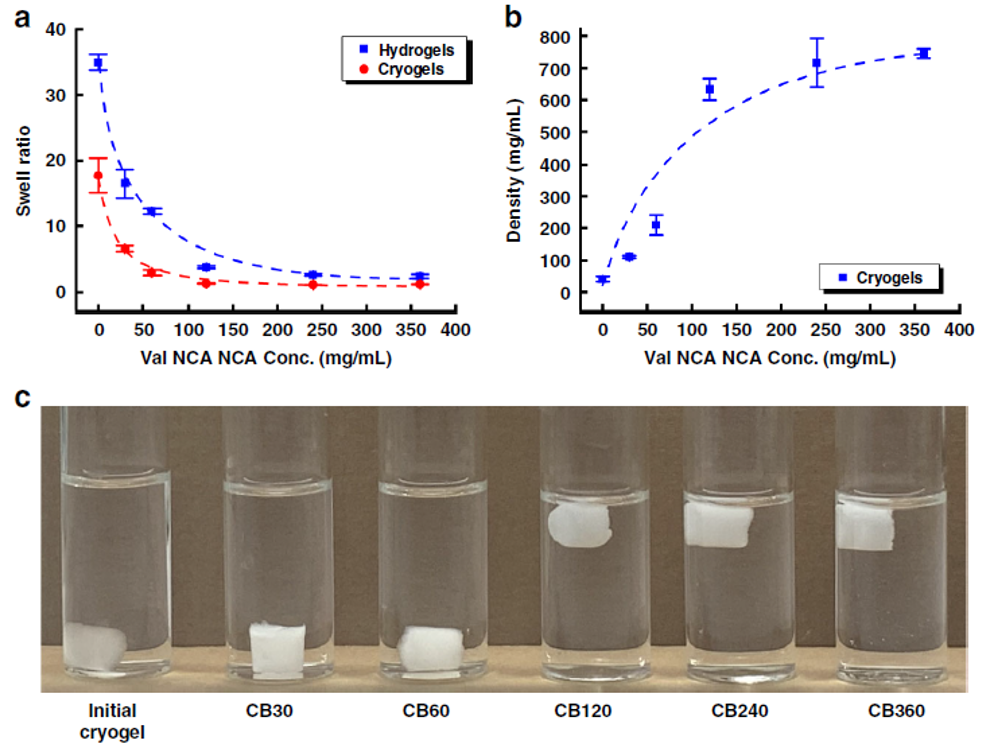
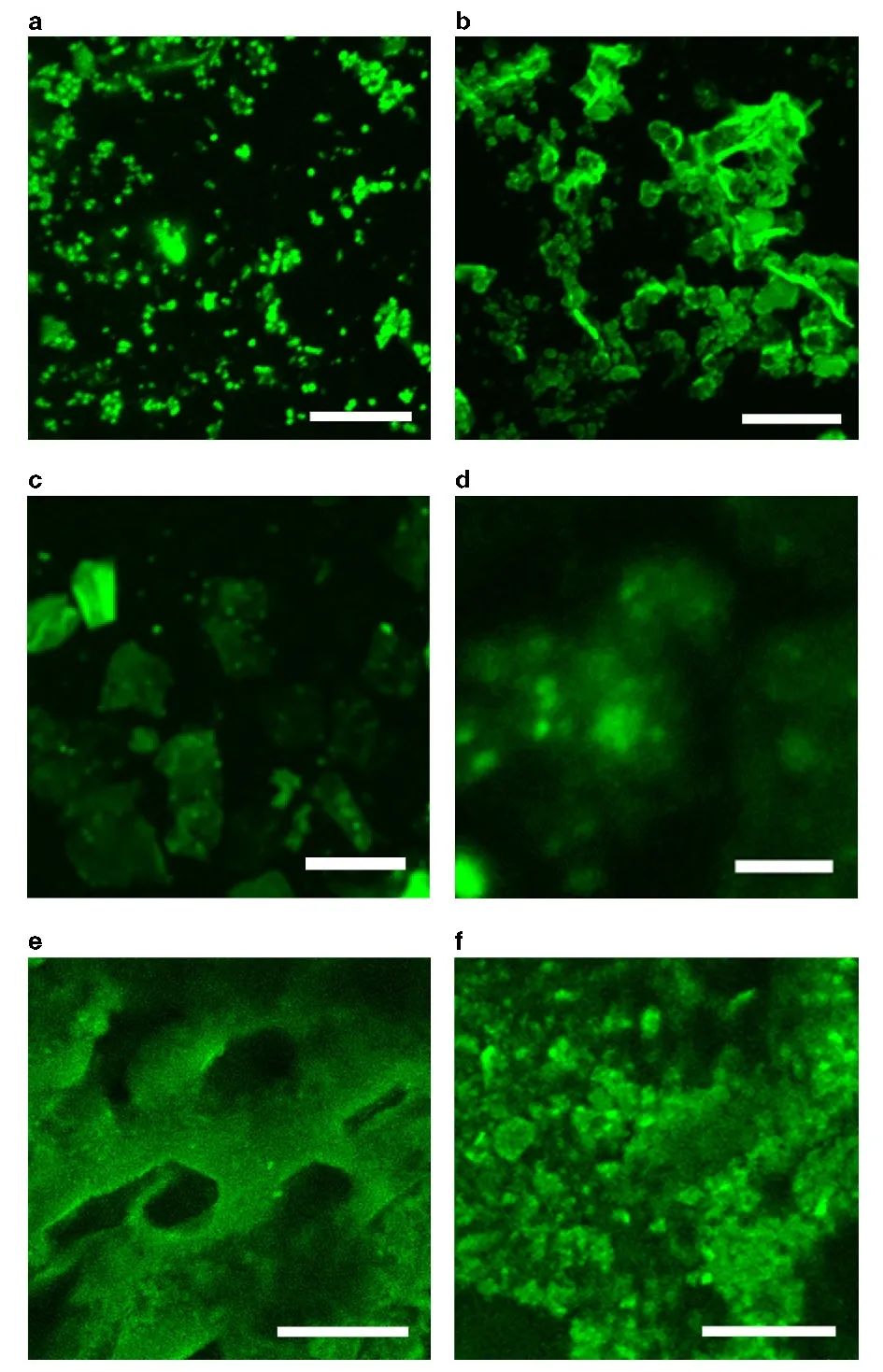
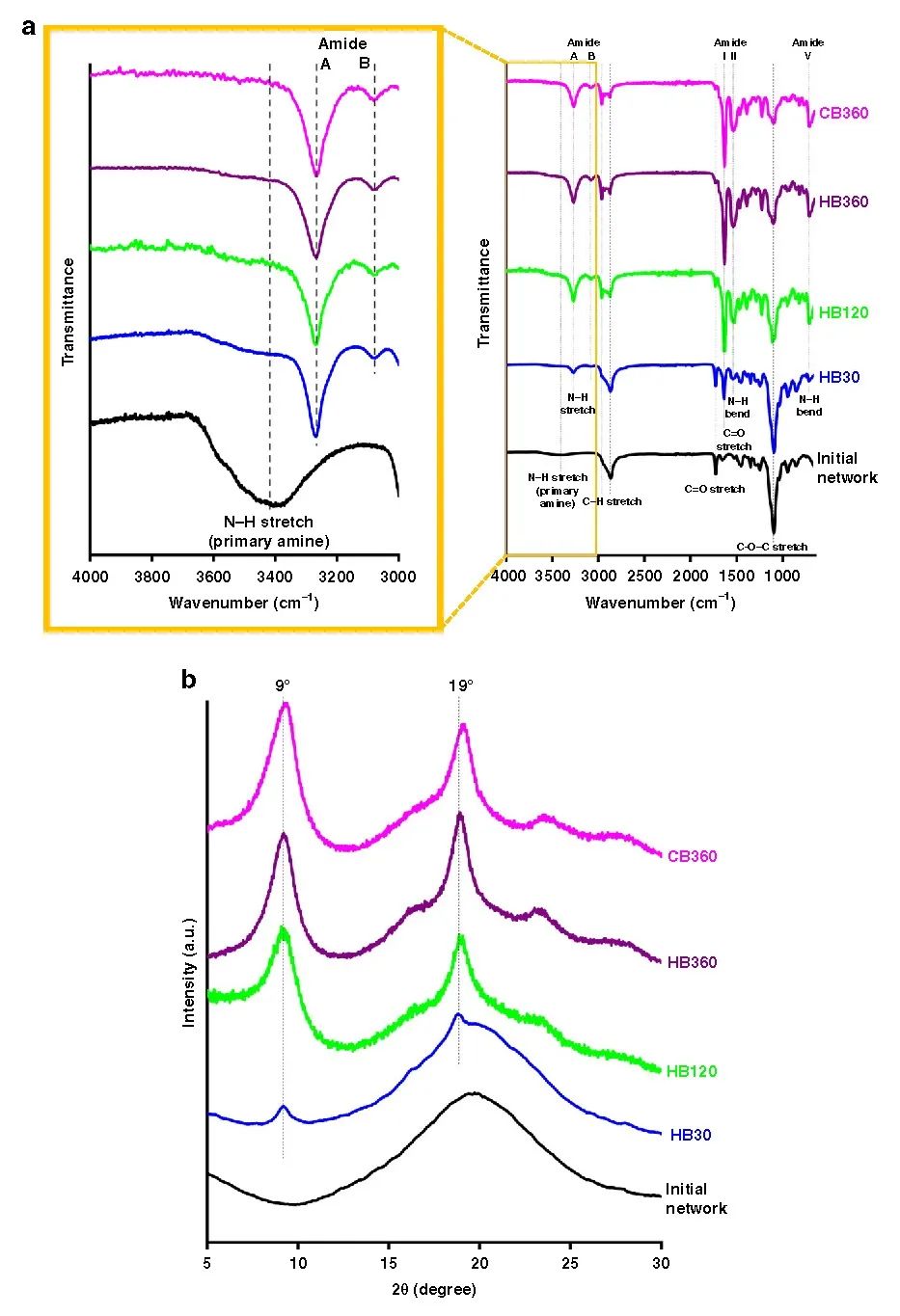
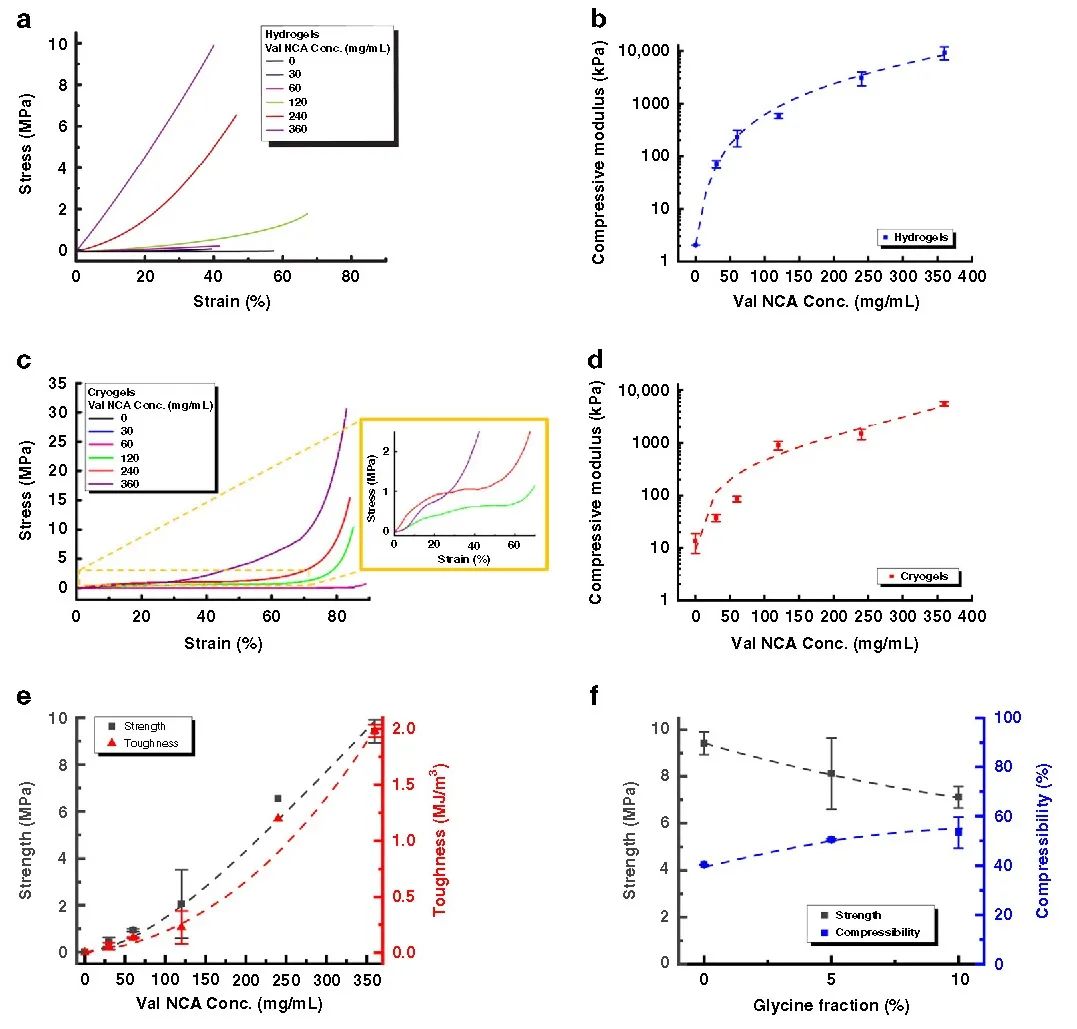
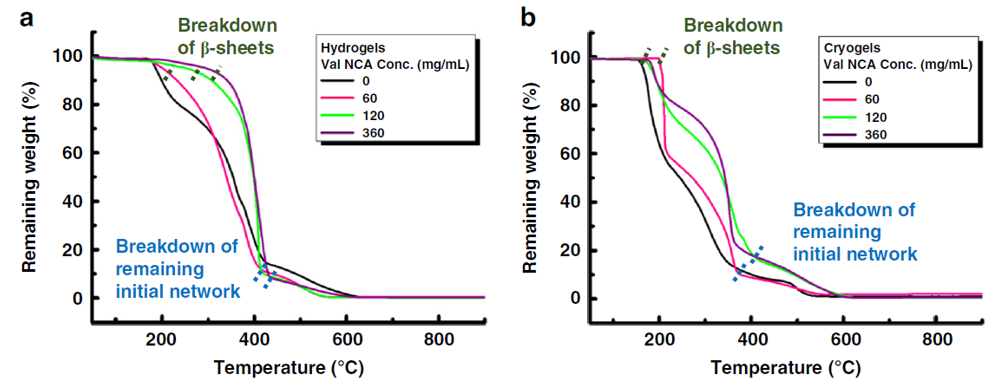
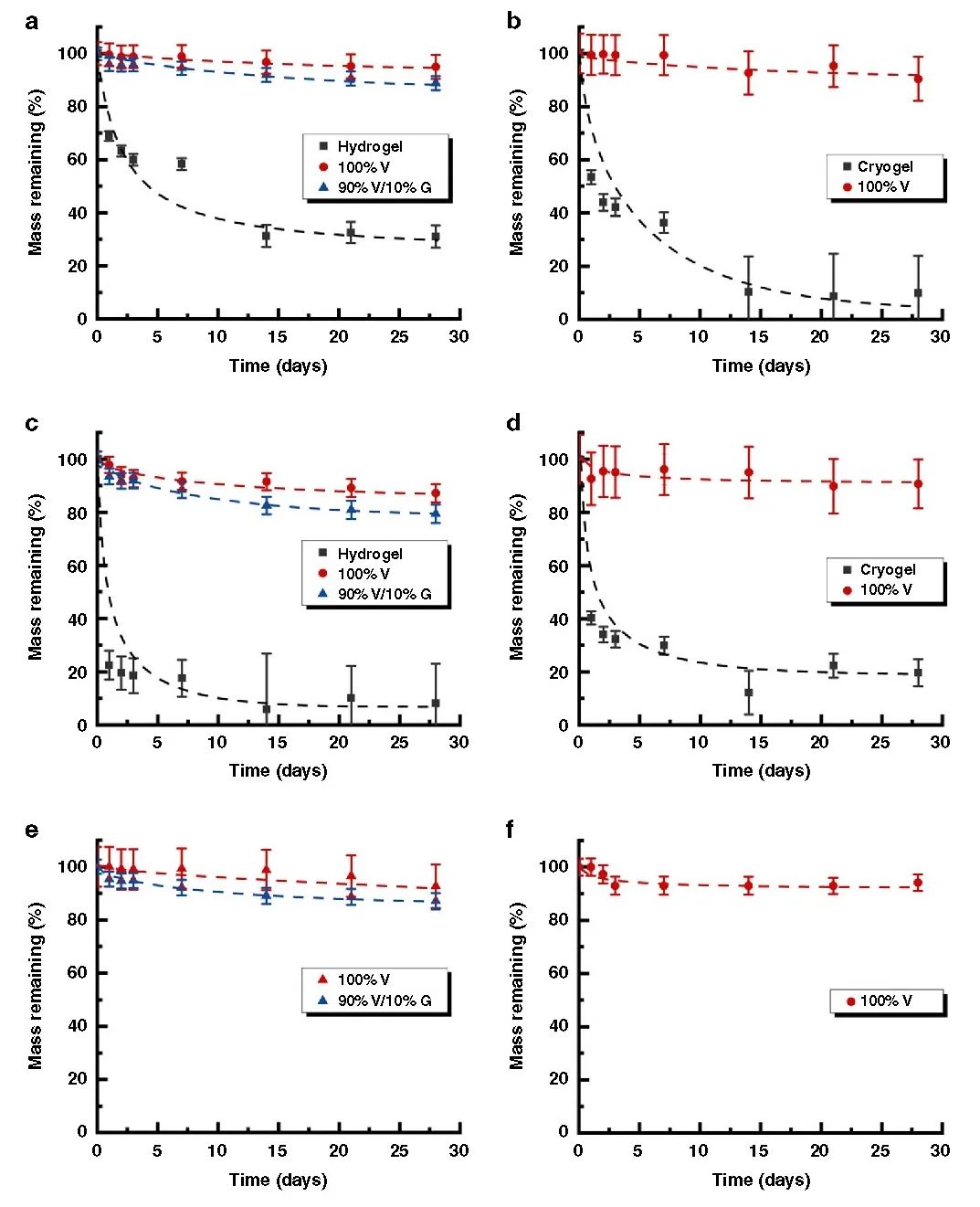
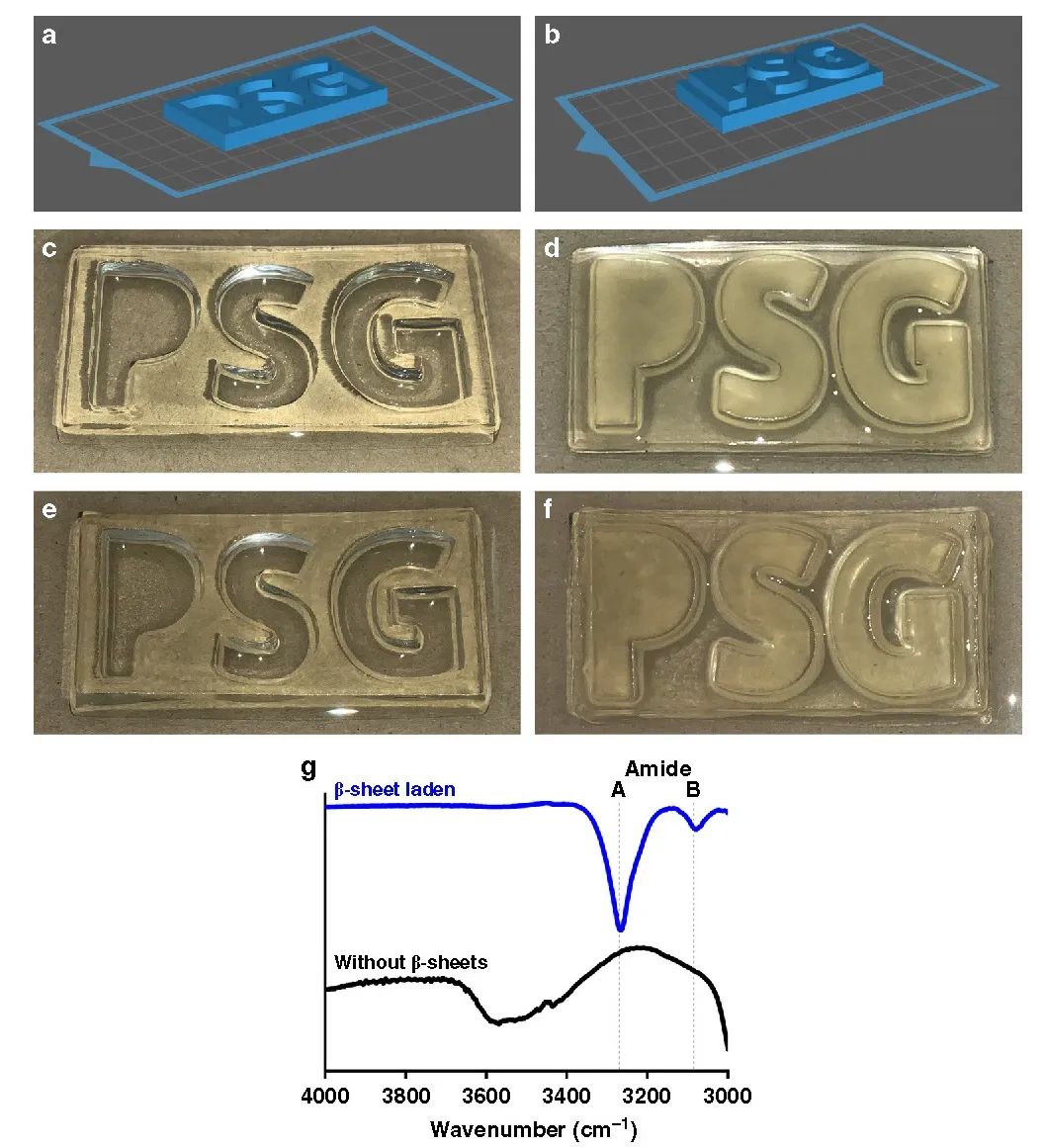
在此,澳大利亚墨尔本大学Greg G. Qiao教授课题组报告了一种通过创造局部β折叠区的简单方法来模拟蜘蛛丝,使形成的块状水凝胶具有优越的力学性能。在水凝胶和晶胶的聚合物主链中引入侧链氨基以启动引导NCA ROP,使得这些β折叠域采用能使这些纳米晶体得到有效利用的构象。这种方法得到平均高达79个重复单元的长链聚缬氨酸接枝物,进而形成连续的β折叠纳米晶网络。实验得到的水凝胶抗压强度增加了3个数量级,达到9.9 MPa,而晶胶的抗压强度增加了2个数量级,达到30 MPa。此外,这些网络的性质可以很容易地使用甘氨酸进行调整,聚(缬氨酸-r-甘氨酸)接枝物使得压缩性从40%增加到60%,而没有明显的韧性损失。该网络显示在28天内对强酸、强碱和蛋白质变性剂的抗腐蚀性有所提高。这种简单的方法为制备独特的带有β折叠的杂化网络提供了强有力的工具,并可进一步用于调节其他用于生物医学功能和材料科学的水凝胶的机械性能和降解性能。相关工作以“Spider-silk inspired polymeric networks by harnessing the mechanical potential of β-sheets through network guided assembly”为题发表在Nature Communications上。
图文速递
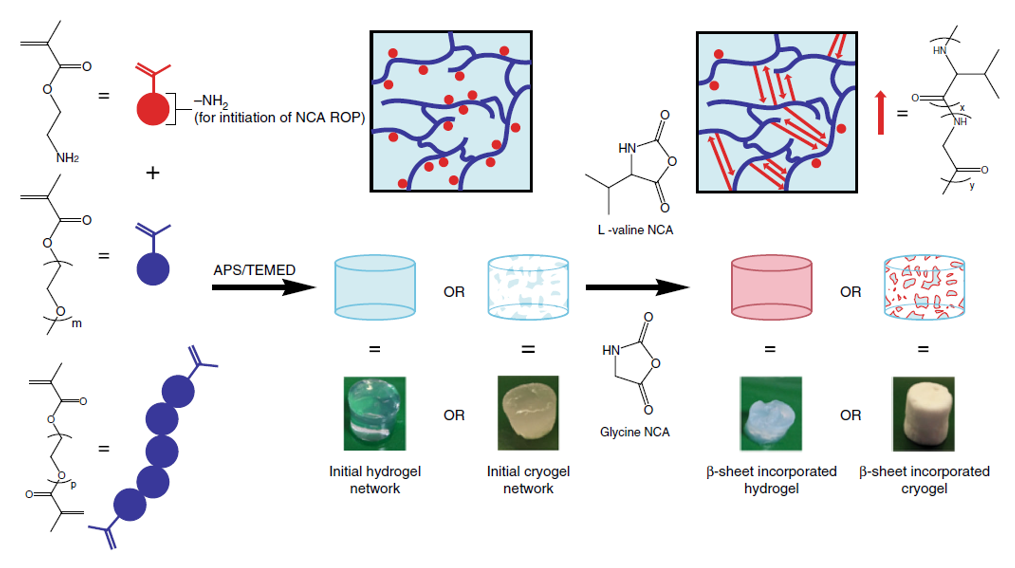
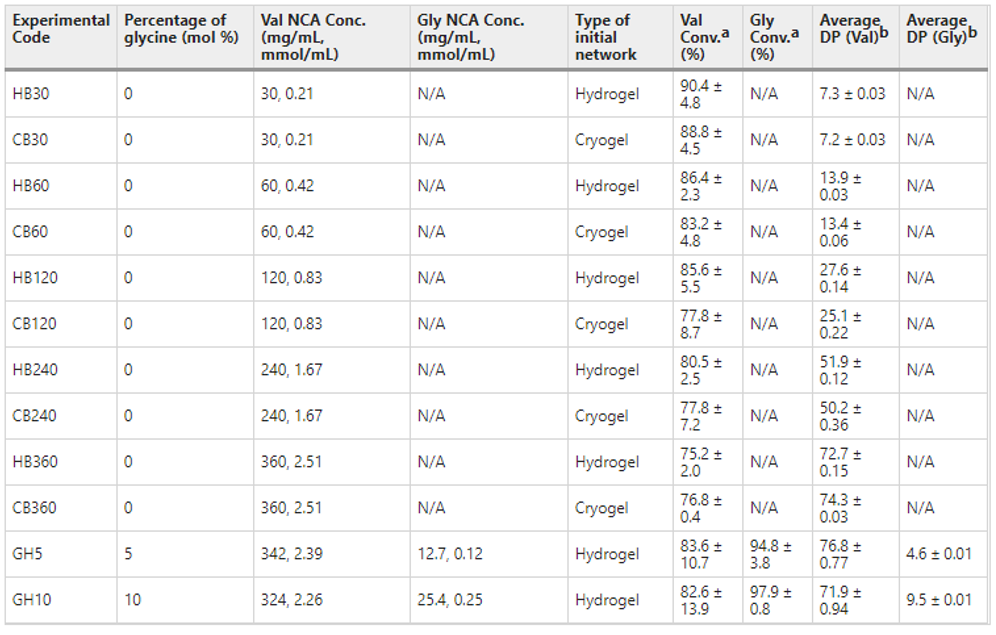
aNCA单体的转化率根据方法中所规定的剩余NCA单体与溶剂特征峰的积分比校准曲线,采用1H NMR测定。正负误差基于标准差(n = 3)。
b平均DP是网络主链每一个-NH2基团的接枝Val重复单元的平均数,由初始网络中转换的Val NCA和-NH2组之间的摩尔比估计(假设整个网络的引发效率和聚合速率相同)。