光动力学疗法(photodynamic therapy, 简称PDT)作为一种微创性和局部性的癌症治疗手段,已在临床治疗食道癌,头颈癌,眼肿瘤,皮肤癌,乳腺癌和肺癌等疾病中取得了良好的疗效。PDT通过无毒的光敏剂(通常为卟啉衍生物)与光(一般为近红外光)和氧气的作用,产生活性氧物种(reactive oxygen species, 简称ROS)并引起细胞毒性,促使癌细胞凋亡或者坏死,并进一步引发肿瘤及周边的免疫反应,使肿瘤消退。尽管PDT作为一种非常强力的治疗手段,但也有以下的缺点:
- 光敏剂会残留于病人体内并造成光敏性副作用(见不得光);
- 光的穿透深度浅,无法有效杀伤距体表较深的肿瘤以及转移组织(深不见底);
- 癌细胞的高代谢导致肿瘤的局部乏氧,进而使得氧依赖的疗法疗效不佳(莫得氧气)。
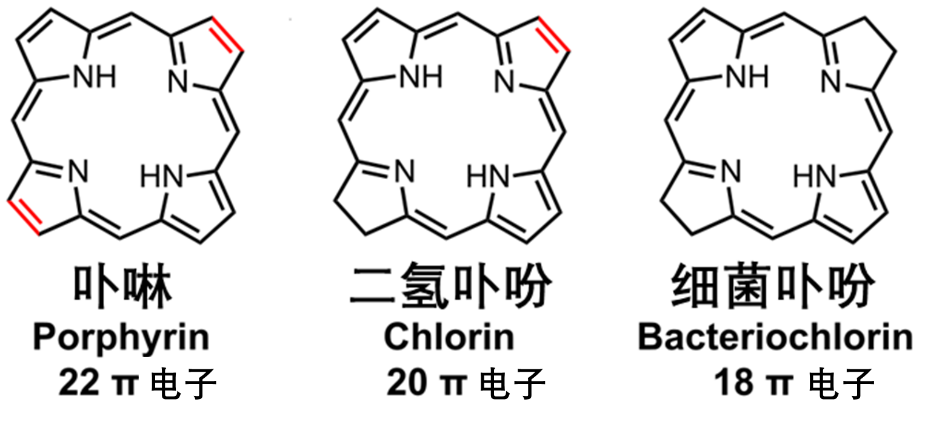
而作为第二代光敏剂的代表化合物之一,细菌卟吩(bacteriochlorin)则成为了解决上述全部问题的候选物。细菌卟吩作为卟啉的还原性衍生物,其拥有以下优点:
- 在可见光区吸收弱,可缓解病人的光敏副作用;
- 用于治疗的光波段处于人体组织的透明窗口(700 nm-850 nm),拥有更强的穿透性;
- 可同步进行I型与II型PDT机理,一定程度上能容忍低氧局部环境。
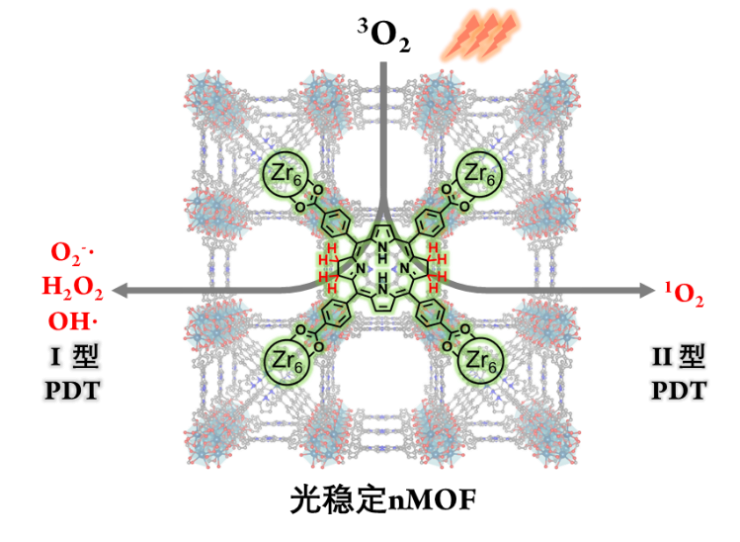
主流的光敏剂如卟啉和二氢卟吩,都基于II型PDT机理,是通过激发态光敏剂耦合基态氧气产生单线态氧,从而杀伤癌细胞,缺点是完全依赖氧气。而细菌卟吩可进行I型PDT,即氧气或者其他分子与激发态光敏剂发生氧化还原反应从而生成活性氧物种,典型的包括超氧负离子(O2-),过氧化氢(H2O2)与羟基自由基(OH)。由于I型PDT的本质是光引发的电子转移导致的氧化还原反应,可以在肿瘤微环境中破坏氧化还原平衡,诱导细胞死亡,因此相对地可以容忍乏氧环境。
作为第二代光敏剂,目前基于细菌卟吩的产品包括在欧洲已经临床获批的TOOKAD用于治疗前列腺癌,以及正在进行临床实验的Redaporfin用于治疗胆道癌,两者均取得了良好的临床治疗结果。但与此同时,由于细菌卟吩对于光和氧气非常敏感,其作为卟啉的还原衍生物,具有较低的氧化还原电势,所以以I型PDT机理作用的同时,也使得常规临床光动力学疗法条件下的细菌卟吩极易发生光漂白(photobleaching),从而丧失疗效。这可以说是与PDT本来的目的背道而驰,会大大削弱其本应有的治疗效果。那么有没有一种方法能够既保持住细菌卟吩的稳定性,让其不那么容易光分解,而又能够保有其本来就有的全部优点呢?为了解决这一问题,研究者们开始了精细而又充满创意的探索。
作为新兴的纳米光敏材料——纳米金属-有机框架化合物(nanoscale metal-organic framework,简称nMOF),因其拥有利于活性氧扩散的多孔结构,防止自猝灭的规整框架结构,较高的光敏剂载荷以及良好的生物相容性,成为用于PDT的理想纳米药物。最近,芝加哥大学林文斌教授实验室报道了用纳米MOF作为稳定细菌卟吩的载体,成功实现I型和II型同步的光动力学疗法,并在小鼠乳腺癌与结肠癌模型中获得了极佳的疗效。
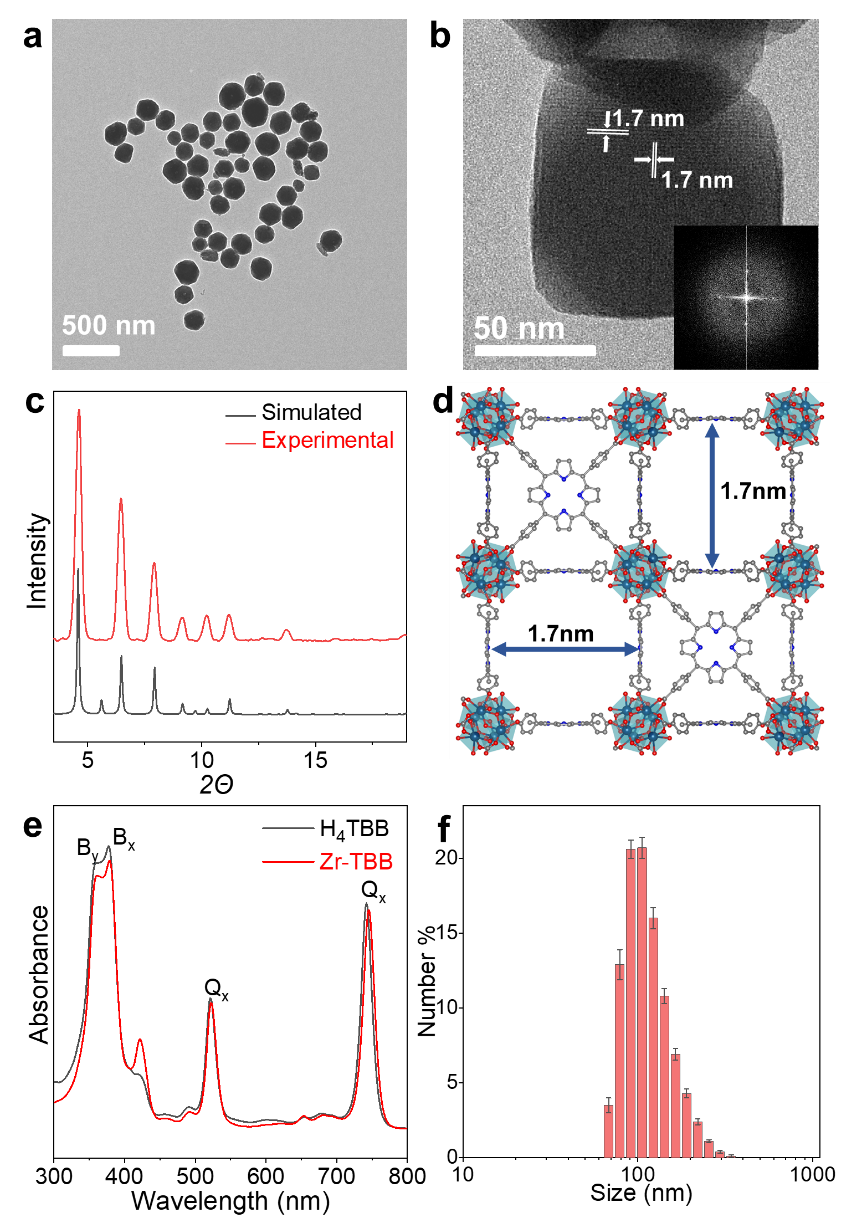
研究者首先合成了作为nMOF配体的具有高对称性的四苯甲酸细菌卟吩(简称TBB),并通过与ZrCl4的溶剂热反应合成了粒径100 nm左右的具有PCN-224结构的纳米MOF(简称Zr-TBB)。Zr-TBB的紫外吸收光谱显示了其在740 nm附近的强吸收,而TEM与PXRD衍射图样证明Zr-TBB晶化良好,具有作为纳米光敏剂的潜质。
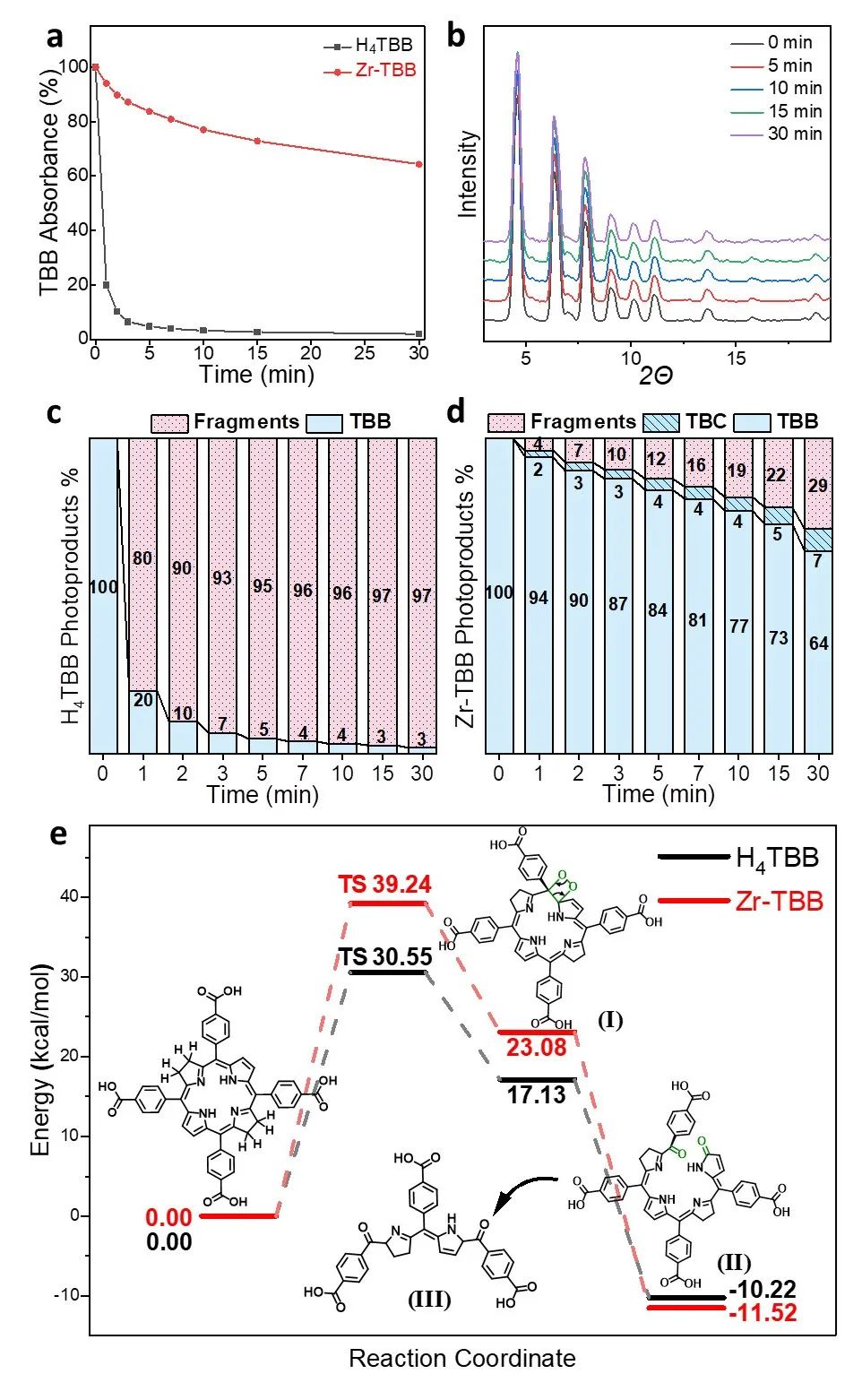
细菌卟吩的光氧化过程是从卟啉环上双键的[2+2]过氧化反应开始的,接着会逆[2+2]开环生成二酮结构,最后连续反应分解变为没有光活性的碎片。在整个反应过程中,细菌卟吩的构象会发生较大的变化,以满足sp2和sp3碳中心的几何构型转变。研究者假设在Zr-TBB nMOF的固定的结构框架中,由于TBB的四个苯甲酸被锆氧团簇连结,TBB不易产生构象与结构的变化,因此相对于自由的细菌卟吩,在Zr-TBB中细菌卟吩配体的光氧化反应会被抑制。实验与计算结果都印证了研究者的猜想,在740 nm 100 mW/cm2 的LED光照射下,Zr-TBB 表现出了卓越的光稳定性。因此,Zr-TBB 作为基于细菌卟吩的纳米光敏剂,显著提升了细菌卟吩的稳定性。
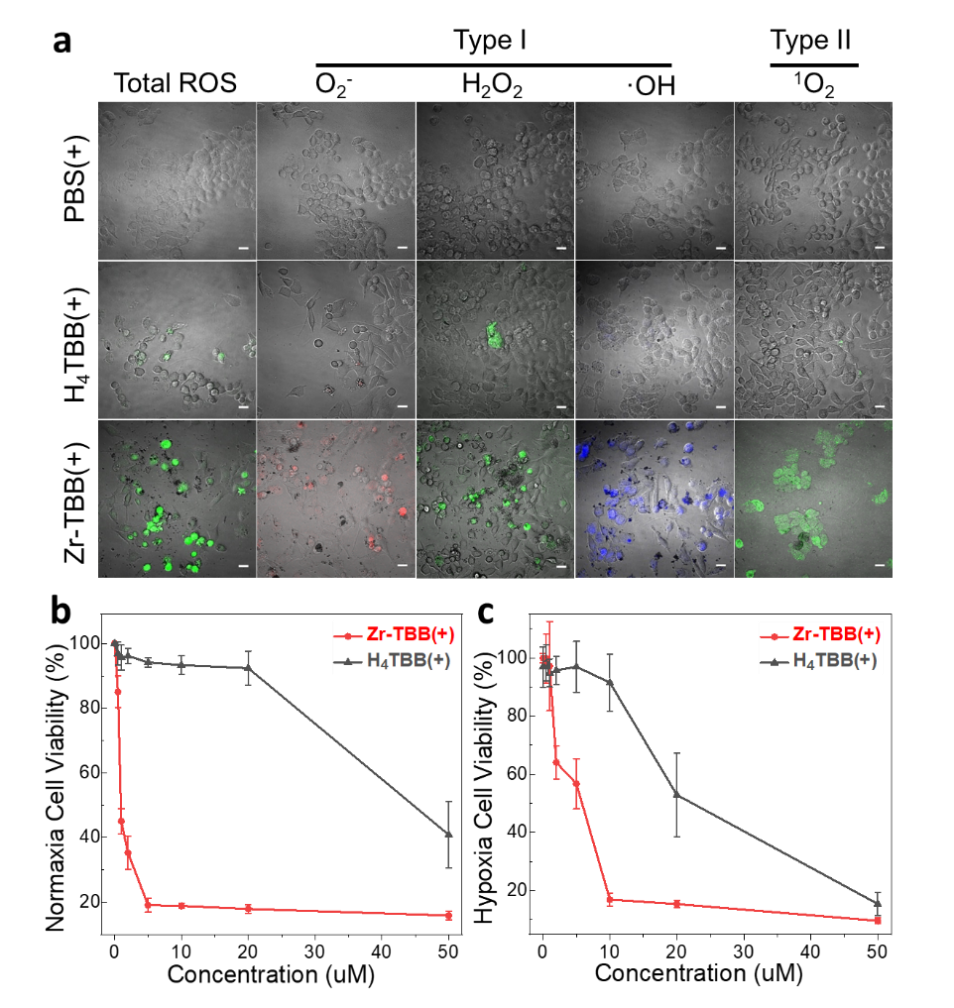
体外实验中,研究者验证了Zr-TBB的活性氧产生机理与效率。通过不同的活性氧检测试剂,证实了在体外环境中TBB可以同时进行I型与II型PDT机制,即对应产生出超氧负离子(O2-),过氧化氢(H2O2),羟基自由基(OH)与单线态氧(1O2)。而且相比于配体自身(H4TBB),Zr-TBB可以产生更强的ROS信息,说明nMOF对于细菌卟吩的稳定大大促进了PDT产生ROS的效率。研究者们同时研究了常氧条件下与乏氧条件下的细胞毒性,证明了即使是在乏氧PDT条件下,Zr-TBB依然可以高效地杀死细胞,再次证明了细菌卟吩I型PDT机理对于乏氧条件的适应。较低的暗毒性也说明了纳米MOF良好的生物相容性。
在证明细胞层面上的ROS生成以及细胞毒性后,研究者们接着在两种小鼠肿瘤模型上(4T1 & MC38)验证Zr-TBB的癌症光动力治疗疗效。在这两种模型上,Zr-TBB光照组均表现出良好的肿瘤抑制效果,并与配体H4TBB光照组有显著性差异。而通过对肿瘤样本切片的钙网蛋白(CRT)检测与脱氧核苷酸末端转移酶介导的dUTP缺口末端标记(TUNEL)检测,Zr-TBB光照组也表现出最强的凋亡信号与免疫原性信号。
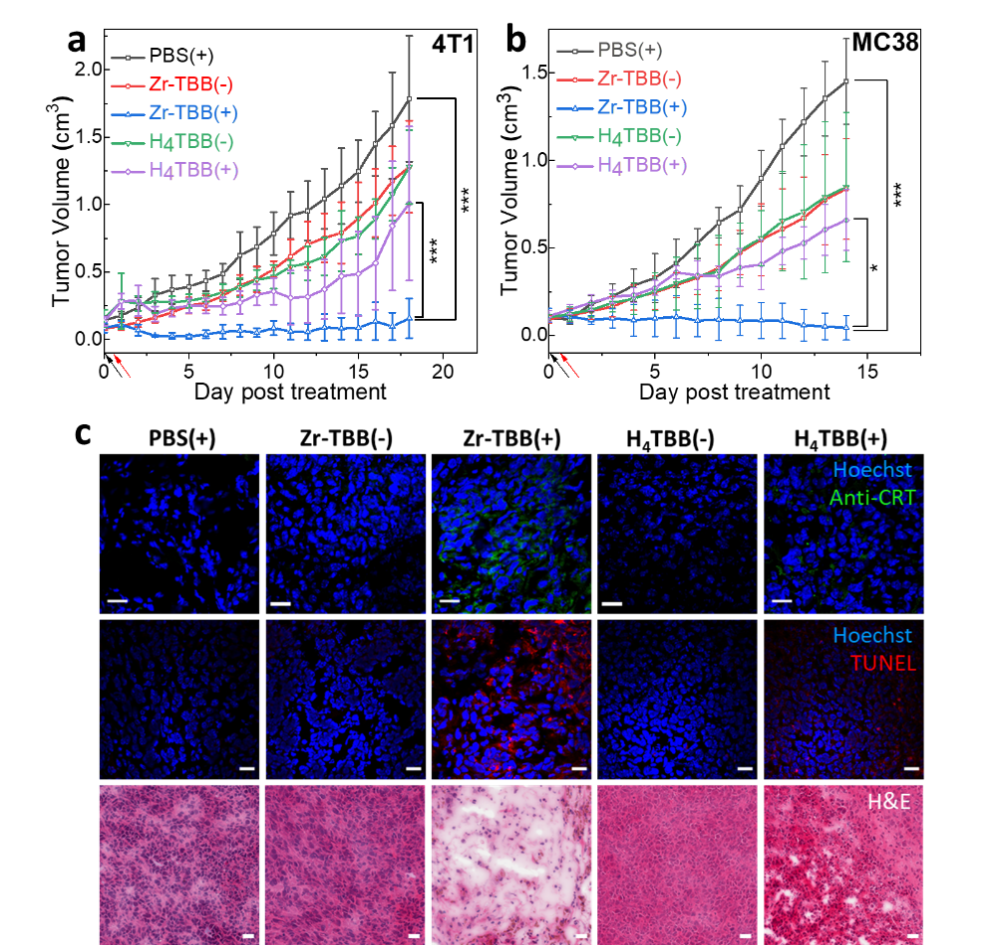
综上所述,研究者们报道了利用Zr-TBB nMOF框架来稳定细菌卟吩进行光动力学疗法。Zr-TBB通过I型和II型PDT机制产生出超氧负离子(O2-),过氧化氢(H2O2),羟基自由基(OH)与单线态氧(1O2)来介导高效的PDT过程。Zr-TBB在乳腺癌和结肠癌的小鼠肿瘤模型上显示出极好的抗肿瘤功效,治愈率分别为40%和60%。因此,纳米MOF提供了一个基于稳定细菌卟吩的新型纳米光敏剂平台,也为其他不稳定分子的生物应用提供了一个可行的思路与方法。这一成果近期发表在《美国化学会志》(JACS)上,文章的第一共同作者是芝加哥大学博士研究生罗韬堃和倪开元。