脊髓损伤(SCI)是一种严重影响躯体功能的疾病,目前临床上尚无基于受损脊髓再生的疗法。脊髓损伤给患者及其家人带来了巨大的经济,身体和情感负担。基于细胞的疗法已成为鼓励脊髓损伤后再生和功能恢复的有前途的方法。目前,美国食品和药物管理局针对胸部和宫颈水平为脊髓损伤的患者正在研究自体人施旺细胞(SCs)的移植 (图1)。人施旺细胞是在周围神经系统中发现的胶质细胞,其在周围神经损伤后促进轴突再生。在过去的二十年中,数项临床前研究表明,人施旺细胞在直接递送至损伤部位后形成的病变腔中后可促进脊髓损伤后的再生。与可能的多能干细胞脊髓损伤再生疗法相比,施旺细胞的纯度高,特征明确,并且相对容易从患者腓肠神经中分离和扩增。不幸的是将SCs直接局部注射到脊髓损伤中会导致大量移植的细胞丢失和死亡。在注射过程中,通常多达60%的细胞甚至无法到达目标部位。这可能是由于多种因素共同作用的结果,包括注射过程中细胞膜的损伤和脊髓中细胞的回流。此外,已有研究表明,细胞注射10分钟后移植细胞的死亡便迅速发生,导致SC生存期较差。通常,只有约20%的细胞在1周后存活,而不到5%的移植SC在移植后1个月存活,但是由于脊髓损伤病变中的移植体积有限,仅增加注射细胞的数量是不可行的。
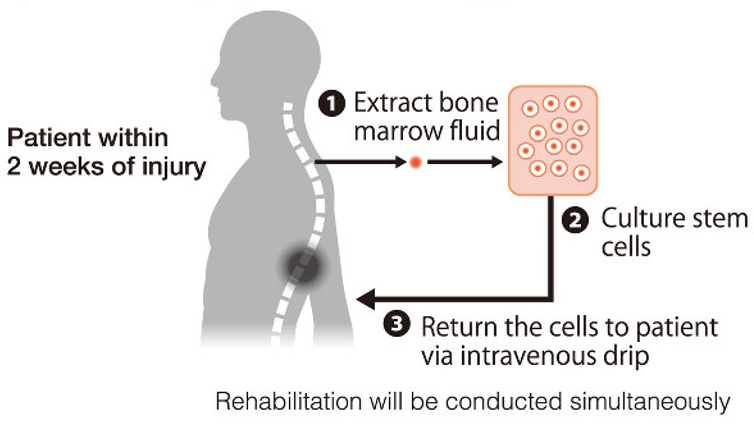
针对上述对于细胞治疗脊髓损伤遇到的问题,斯坦福大学材料科学与工程学院Sarah C. Heilshorn 教授课题组在Science Advance发表文章提出使用可注射高分子水凝胶材料策略来解决阻碍脊髓损伤移植期间SC存活的三个关键挑战。
在这项研究中,作者们使用使用可注射高分子水凝胶材料解决阻碍脊髓损伤移植期间SC存活的三个关键挑战(图2)。在细胞递送过程中,细胞损失是由(i)注射期间的拉伸力引起的细胞膜损伤和(ii)注射部位细胞的回流和渗漏引起的细胞流失。注射后不久,(iii)病变组织内缺乏细胞外基质(ECM),进一步降低了注射细胞存活率,导致依赖于贴壁生长的SCs的凋亡。因此,要使移植的细胞能够与周围的内源性组织相互作用并促进长期修复,细胞治疗必须首先克服这三个关键挑战。
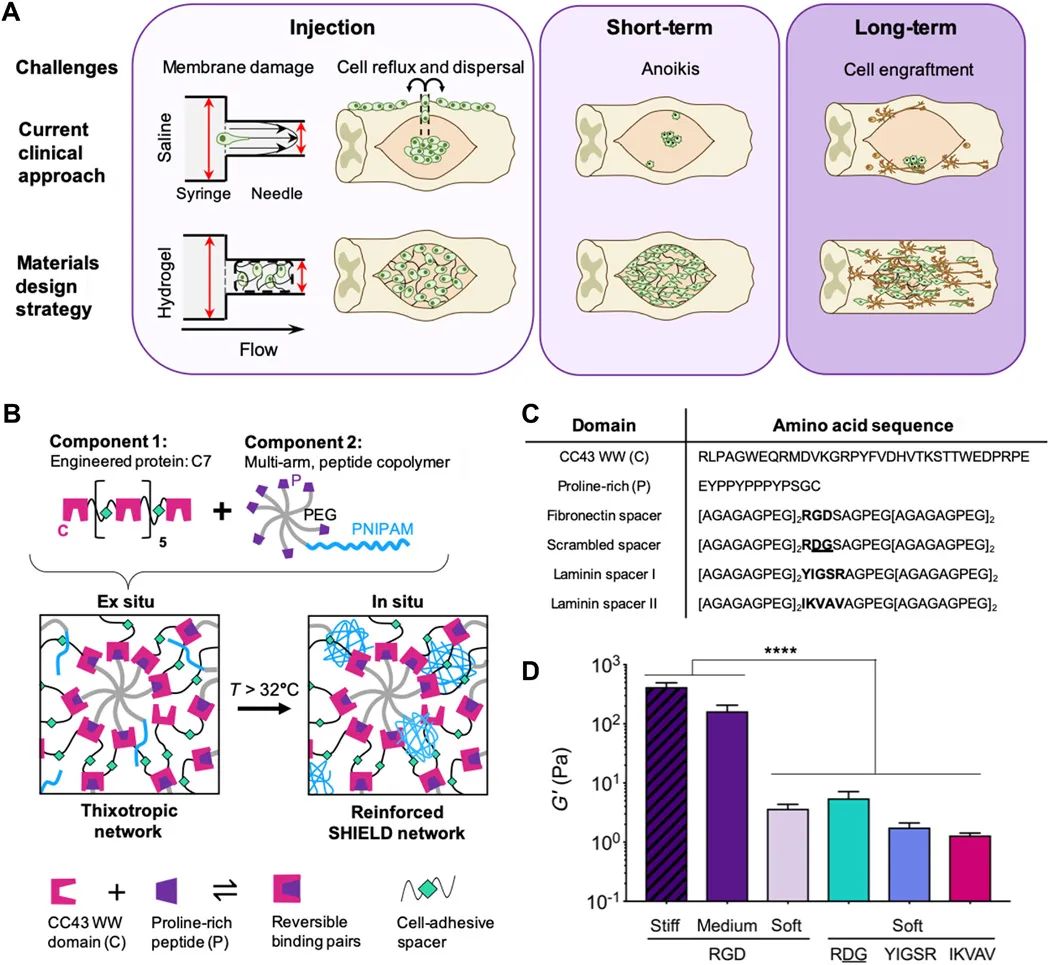
本文系统展示了水凝胶材料中设计了三个不同的特征,并且提出新策略以解决上述移植细胞存活的三个关键挑战:(i)剪切力流变性以保护细胞膜在注射过程中不受损害;(ii)快速自我修复和原位硬度提升以稳定注射到脊髓损伤病变部位内的细胞,以及(iii)促进SC附着和添加促进细胞粘附性配体。
具体步骤:
1、可注射水凝胶的设计
水凝胶第一阶段发生在重组蛋白(C7)和与富含脯氨酸的肽结合的多臂聚乙二醇(PEG)-聚(N-异丙基丙烯酰胺)(PNIPAM)共聚物之间形成物理交联(图3,B和C)。这两个组分通过两个肽结构域(CC43 WW结构域和富含脯氨酸的肽)的可逆异二聚体结合异位组装,从而形成带有包封的SC的弱凝胶。当凝胶受到作用力时,肽-肽键断裂,使材料剪切稀薄并以液体形式流动。消除作用力后,肽-肽键迅速重整,使凝胶快速自愈。
水凝胶交联的第二阶段发生在原位注射后,用以稳定和提升凝胶硬度从而防止细胞挤出和从病变部位中流失。在高于PNIPAM最低临界溶液温度32°C的体温下,聚合物会发生分子内氢键作用力交联,从而提供二次物理交联来加强和增强水凝胶网络(图3B)。由于目前尚不清楚在脊髓损伤病变内能否保留可行的已移植SC的理想凝胶硬度,因此本文配制了具有一定范围的热响应性PNIPAM聚合物的材料,分别得到了软凝胶,中等硬度凝胶和高硬度凝胶(图3D)。这些材料涵盖了脊髓损伤病变的报道的神经组织硬度的大致范围。

2、可注射水凝胶为注入的SC提供细胞膜保护。
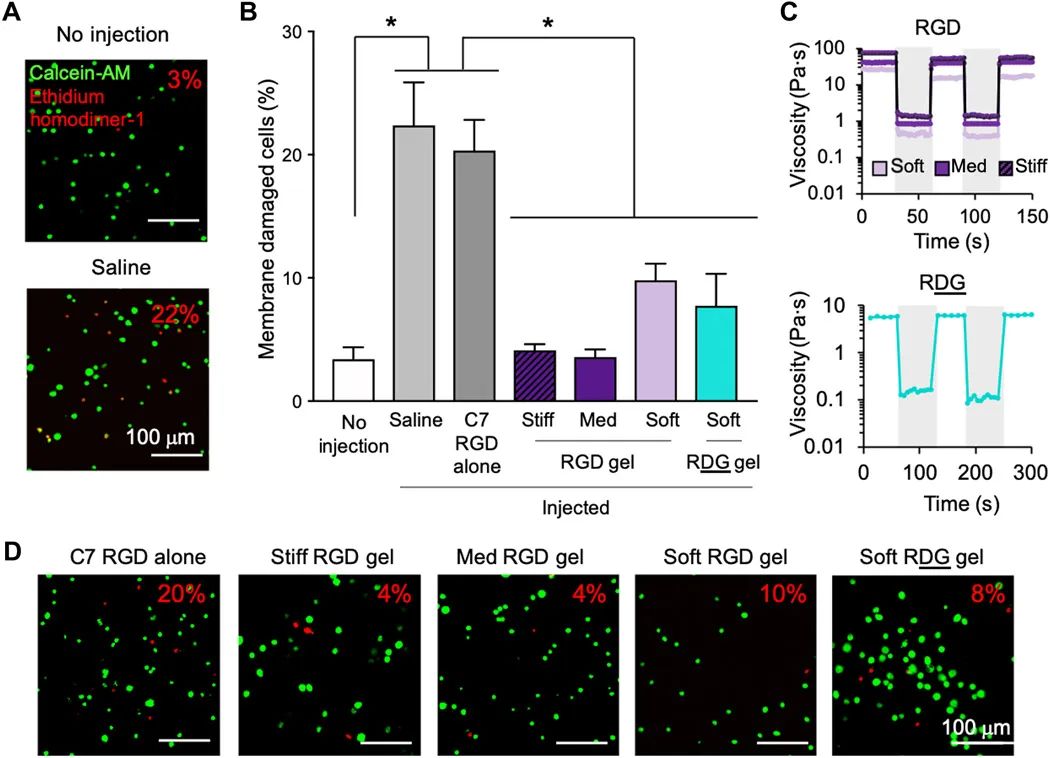
当在注射针头注射过程中受到拉伸力时,细胞会受到膜的破坏(图2A)。假设即使在注射的流速非常慢时(500 nl / min)也会发生这种情况,因为溶液线速度的大小变化由注射器针头装置的几何形状决定。当细胞从注射器筒 [内径(ID)= 0.485 mm] 进入超小针头(33号,ID = 0.11 mm)时,流体线速度增加了20倍。为了评估设计的水凝胶材料在移植过程中保护SC免受细胞膜损伤的能力,本文使用体内移植研究(材料和方法)中所述的相同注射参数。当细胞在生理盐水或C7 RGD聚合物的粘稠溶液(5 wt%)中递送时,观察到很明显的细胞膜损伤(分别为25%和20%)。将C7 RGD聚合物与PEG-P-PNIPAM聚合物(均以5 wt%的最终浓度混合)可以产生剪切稀化的快速自修复水凝胶(图4C),改变凝胶配方中细胞粘附配体或PNIPAM的量不会改变剪切稀化的凝胶行为(图4C)。将这些SC预先封装在这些水凝胶变体中,可在注射针头流动期间提供显着的细胞膜保护(图4,A和D)。与在盐水中递送细胞相比,软,中等硬度的水凝胶具有更高水平的细胞保护。材料中是否存在RGD细胞粘附域也不会影响细胞膜保护并且观察到单独的C7 RGD聚合物无法提供保护。这些数据表明,凝胶的剪切稀化/自修复特性(而不是凝胶细胞的粘合特性)是可注射水凝胶能够提供细胞膜保护的原因。
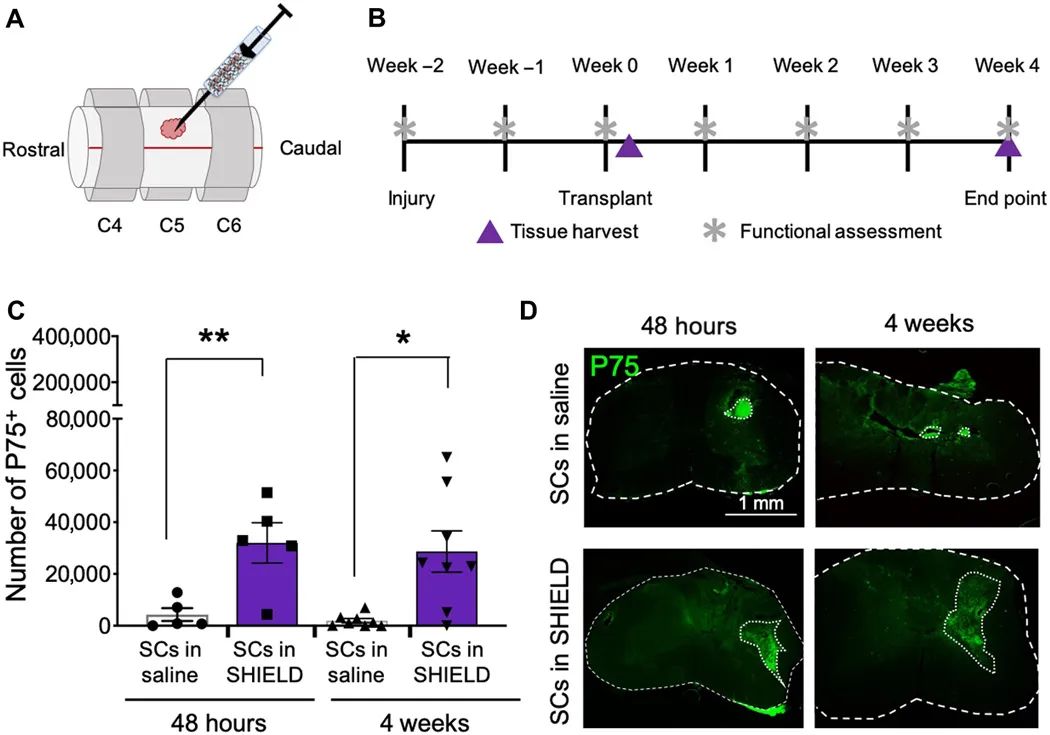
3 、注射水凝胶增加了移植的SC保留和扩散形态。
本文在雌性Fischer 344大鼠中选择了单侧颈挫伤脊髓损伤模型,以代表患者中最常见的脊髓损伤。在进行背侧椎板切除术后在第五个颈椎(C5)水平上进行了右侧的75-kdyne挫伤(图5A)。在移植后48小时(N = 10)和4周(N = 16)评估移植的SC保留率。与体外移植模型数据一致,当在水凝胶中递送时,与盐水相比在病变部位观察到的P75 +细胞数量明显增加(图5D)。在第48小时,在水凝胶注射的动物中观察到32,000±7700个存活的移植细胞而接受生理盐水注射的动物中发现4300±2500存活的移植细胞。在第4周,观察到可注射水凝胶递送了29,000±8000个活细胞,而盐水递送的动物计数了2400±800个活细胞,与盐水相比,活细胞的局部递送增加了约10倍。在两个时间点的脊髓横截面中与盐水递送相比观察到了较多的SC递送(图5E)。结合本文的体外数据,这些观察结果表明,使用剪切稀化的自修复水凝胶可通过在注射过程中提供细胞膜保护并限制细胞从注射部位渗出从而显着改善SC向脊髓损伤病变部位的递送。
4、水凝胶介导的细胞递送增加功能恢复
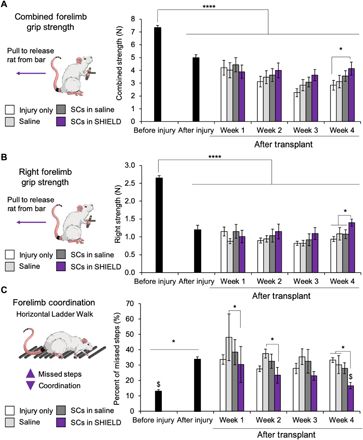
本文评估了组合细胞和可注射水凝胶疗法对功能性前肢恢复的作用。进行运动和感觉运动测试均可以获得更正确的右前肢功能图,因为挫伤性脊髓损伤可导致运动和感觉缺陷。为了评估前肢运动恢复,本文测量了前肢的抓地力,例如评估组合的力量和右臂力量用以评估左臂补偿是否影响右臂行为。结果表明,单侧C5挫伤会同时导致合并和右前肢握力下降,并且在仅右前臂的测试中这种下降明显更大(图6,A和B)。在合并前肢和右前肢评估中,观察到与仅损伤对照组相比在可注射水凝胶中用SC进行治疗的动物的抓地力显着增加(图6,A和B)。此外,在接受注射水凝胶治疗的动物中,SC的右前肢握力明显高于生理盐水中的SC(图6,A和B),但是在盐水中用SCs处理的动物没有观察到明显的改善。本文还通过水平梯步走试验评估了动物的感觉运动恢复。该方法通过计算动物横穿间隔不均匀的横梯时前臂错过的步数来测量前肢的协调性,观察到颈挫伤后脊髓损伤遗漏的步骤明显增加(图6C)。
总结与展望:
本文系统探究了新型设计的可注射水凝胶与生理盐水递送的临床标准相比,让注射的细胞在病变部位的保留能力有了显着改善。大量的表征结果表明,可以通过使用水凝胶系统的模块化设计,例如水凝胶与细胞粘附多肽进行组合从而通过完整系统的探究来进行进一步的优化以进一步提高细胞存活率。此外,在本研究报告了细胞加水凝胶联合疗法对脊柱再生和功能恢复的使用。未来继续进行注射水凝胶优化的实验机会凸显了新型可注射水凝胶的应用潜力,不仅可用于脊髓损伤的治疗,还可用于具有类似局限性的许多其他临床适应症。最后,虽然该研究集中在针对SC注射移植而设计的水凝胶的使用,但本研究对于使用其他细胞类型治疗脊髓损伤具有更广泛的意义。
参考文献
Marquardt L M, Doulames V M, Wang A T, et al. Designer, injectable gels to prevent transplanted Schwann cell loss during spinal cord injury therapy[J]. Science Advances, 2020, 6(14): eaaz1039.
全文链接:



