在生物体中,细胞的行为与命运跟细胞表面受体与细胞外基质中具有生物活性的配体相互作用有非常紧密的联系。这种细胞与配体的识别可以诱导细胞的黏附,进而动态调节细胞对细胞基质中信号的感知。细胞外基质中最广泛用于调节细胞黏附行为的配体RGD短肽,可以与细胞膜上的整合素动态结合,激活细胞内经典的细胞通路,实现对细胞行为与分化的调节。此外,边教授课题组最近发现并且报道了一种新型的Foxy5短肽,可以模拟Wnt5a 增强人骨髓间充质干细胞成骨分化(Li et al., Science. Advances. 2019; 5 : eaaw3896)。通过细致的研究,我们证实了Foxy5可以通过非经典细胞通路增强人骨髓间中质干细胞的力学传导并诱使其成骨分化。在本研究中,作者将两种调控配体修饰于同一仿生单链高分子纳米胶中,通过动态调控单链纳米胶的构象变化,进一步证明了非经典细胞通路的激活可以进一步与传统的细胞通路的激活相结合,实现对人骨髓间中质干细胞行为与分化与动态协同调控。这一基于仿生单链纳米凝胶的材料设计方法,未来有望应用于更多不同的配体体系,来研究多种配体共同作用下的细胞行为。这项研究最近以Biomimetic Presentation of Cryptic Ligands via Single-Chain Nanogels for Synergistic Regulation of Stem Cells 为题发表于ACS Nano (https://doi.org/10.1021/acsnano.9b08564)。
1. 仿生单链纳米凝胶的设计与制备:
首先,研究者基于前期对可控的可逆加成-断裂链转移聚合(RFAT)的过程与机理研究,成功制备了具有两种生物配体的单链纳米凝胶。并且通过共聚合一种活性配体在折叠的单链凝胶内,实现对其暂时性的隐藏。这种隐藏配体可以在特定时间通过外界刺激而选择性表达,进而实现对干细胞行为与分化的多配体协同作用与调控。
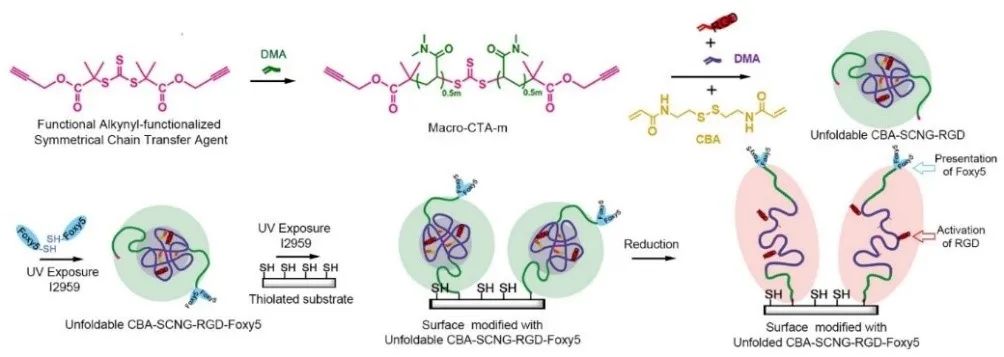
2. 仿生单链纳米凝胶对干细胞行为与分化的调控:
具有隐藏配体结构的单链纳米结构保证了双重配体受限于较短的变化距离,可以更准确和高效的作用于单一受体细胞。为了研究多种配体表达对干细胞的影响与调节效率,研究者首先将细胞培养于修饰了仿生单链纳米凝胶的玻璃板上,在特定时间刺激一部分材料进行双配体协同表达,通过观察干细胞的形态与分化表达的变化,证实了仿生单链纳米凝胶可以通过多配体协同作用实现高效调控干细胞的行与分化。
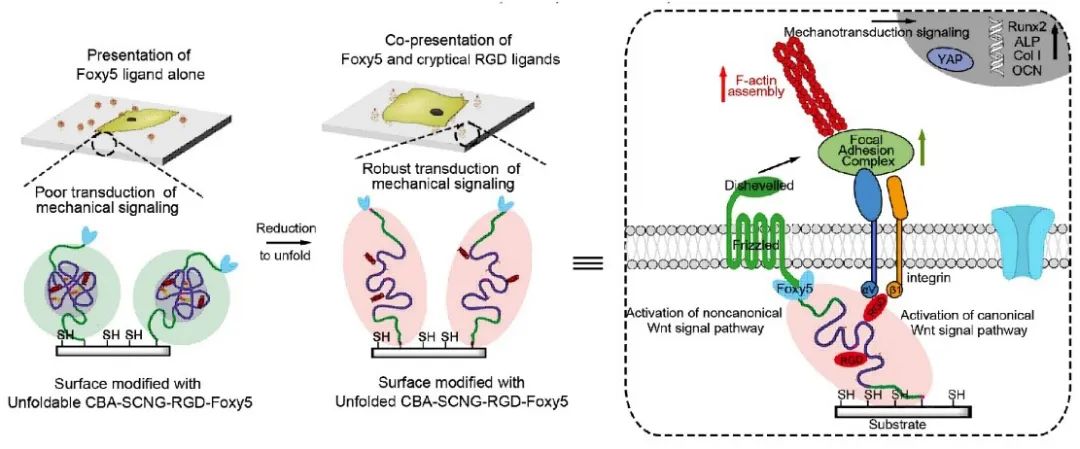
此研究工作中报道的动态单链纳米凝胶展现出来对天然细胞外基质多级刺激结构的初步模拟,为研究细胞与外基质相互作用机制提供了更为灵活的平台。这一平台未来有望应用于对癌细胞,免疫细胞等更多种细胞与多配体表达调控的研究,为生物医学工作者研究细胞与信号作用机理和应用提供更精密有利的工具。
该研究工作由香港中文大学,瑞士联邦材料科学与技术研究院,英国曼彻斯特大学,中山大学合作完成。香港中文大学博士生陈霄宇,励晋谦,和瑞士材料科学与技术研究院韦孔昌研究员为论文共同第一作者。曼彻斯特大学LI Jiashen 教授和中山大学帅心涛教授等为论文共同作者,香港中文大学边黎明教授为论文通讯作者。
边教授近期相关学术论文:
1. Li, R; et al.; *Bian, L. Synthetic presentation of noncanonical Wnt5a motif promotes mechanosensing-dependent differentiation of stem cells and regeneration. Science Advances, 2019, 5: eaaw3896.
2. Zhou, H.; Liang, C.; Wei, Z.; Bai, Y.; Bhaduri, S.B; Webster, T. J.; *Bian, L.; *Yang, L. Injectable biomaterials for translational medicine. Materials Today, in press.
3. Chen, X.; et al.; *Bian, L. Conformational manipulation of scale-up prepared single chain polymeric nanogels for multiscale regulation of cells. Nature Communications, 2019, volume 10, Article number: 2075.
4. +Feng, Q.; +Xu, J.; et al.; *Qin, L; *Bian, L. Dynamic and cell-infiltratable hydrogels as injectable carrier of therapeutic cells and drugs for treating challenging bone defects. ACS Central Science, 2019, 5 (3), pp 440–450.
5. +Kang, H.; +Wong, S.H.D.; et al.; Li, G.; *Bian, L. Anisotropic ligand nanogeometry modulates the adhesion and polarization state of macrophages. Nano Letters, 2019 Mar 13;19(3):1963-1975.
6. +Wong, S.H.D.; +Yin, B.; et al.; Li, G.; *Choi, C. H.; *Bian, L. Anisotropic nanoscale presentation of cell adhesion ligand enhances the recruitment of diverse integrins in adhesion structures and mechanosensing-dependent differentiation of stem cells. Advanced Functional Materials, Volume 29, Issue 8, 2019, adfm.201806822.
7. +Kang, H.; +Yang, B.; et al.; Li, G.; *Bian, L. Immunoregulation of macrophages by dynamic ligand presentation via ligand-cation coordination. Nature Communications, 2019, volume 10, Article number: 1696.
8. +Kang, H.; +Zhang, K.; et al.; Dravid, V.; *Bian, L. In situ reversible heterodimeric nanoswitch controlled by metal ion-ligand coordination regulates the adhesion, release, and differentiation of stem cells. Advanced Materials, 2018 Nov; 30(44), adma.201803591.
9. +Zhang, K.; +Yuan, W.; et al.; *Zhang, Z.; *Bian, L. Highly dynamic nanocomposite hydrogels self-assembled by metal ion-ligand coordination, Small, 2019, smll.201900242.
10. +Zhang, K.; +Jia, Z.; et al.; *Wang, D.; *Bian, L. Adaptable hydrogels mediate cofactor-assisted activation of biomarker-responsive drug delivery via positive feedback for enhanced tissue regeneration. Advanced Science, 2018 Dec; 5(12): 1800875.


