1、对纳米药物输送机制的质疑
由于肿瘤生长速度明显高于正常组织,肿瘤血管内皮细胞之间存在缺陷,排列不紧密,具有渗透性,且肿瘤内部淋巴引流不足,血液流速较低,纳米粒子一旦进入,便会被滞留在肿瘤部位,这种现象称为EPR(enhanced permeability and retention)效应。EPR效应自上世纪80年代末报道以来,被公认为是纳米粒子在肿瘤部位富集的主要因素。但近期,多伦多大学的Warren C. W. Chan团队探讨了纳米颗粒的肿瘤渗透现象,并对纳米粒子进入实体肿瘤的机制提出了质疑。充分的证据表明,转胞吞作用可能是纳米粒子在肿瘤部位富集的主要机制。该文以“The entry of nanoparticles into solid tumours”为题发表在Nature Materials上。由于结论颠覆了以往认知,该文一出便受到研究者广泛关注,Nature Materials一天内刊登了关于该文的社论、新闻与观点、评论文章三篇文章,呼吁进一步探究肿瘤治疗的挑战与未来。
内皮细胞间的间隙被认为是EPR效应的主导因素之一,但是作者通过研究观察发现,内皮细胞间隙出现的频率并不高。在所有肿瘤模型中,作者观察了313根血管,只发现26处间隙,总间隙覆盖率仅为血管表面积的0.048%,内皮间间隙的数量比实验测量的纳米粒子积累的数量少60倍。这虽然为EPR效应提供了证据,但不能充分解释纳米粒子在肿瘤部位的富集现象。
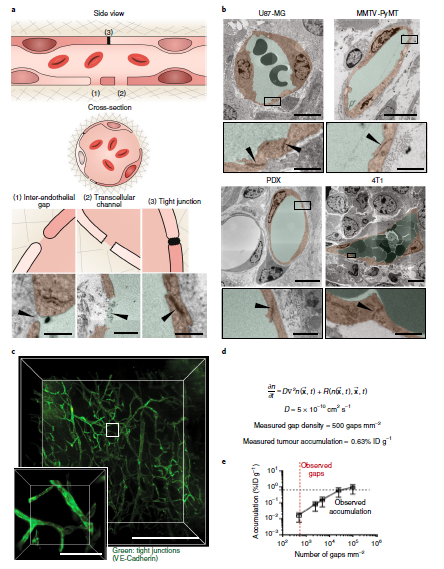
然后作者研究了转胞吞作用对纳米粒子在肿瘤部位富集的影响。胞吞作用是一种需要内皮细胞重新排列细胞骨架和细胞膜的活性代谢过程,包括形成可以吸收纳米颗粒的囊泡,形成称为孔壁的横膈膜或通过细胞质转运。作者制备了三种尺寸((15 nm、50 nm和100 nm)的金纳米粒子AuNPs,在TEM照片中明显观察到转运AuNPs的囊泡,且AuNPs与肿瘤血管内皮细胞有明显相互作用并被后者吸收,为转胞吞提供了直接证据。
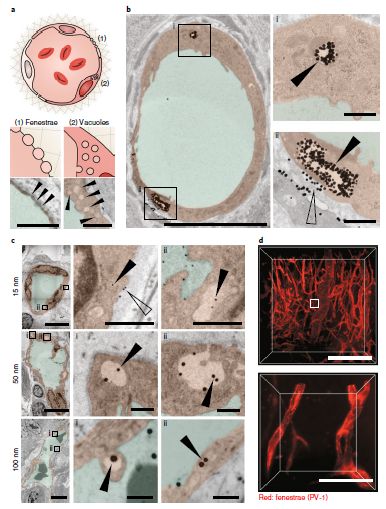
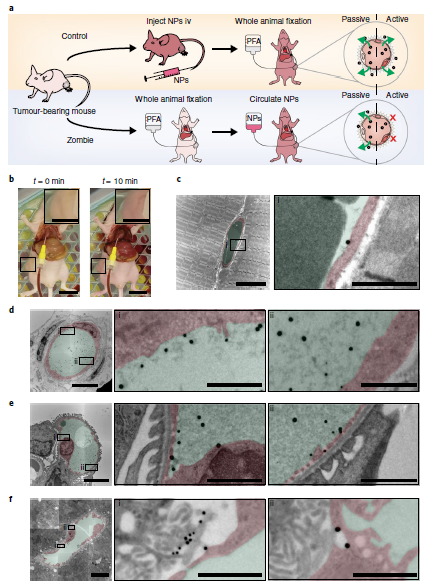
考虑到两种机制的共存,作者进一步对哪种机制起到主导作用进行了验证。通过建立小鼠模型,使其在保留血管结构的同时丧失其他细胞活性,将被动的内皮细胞间隙因素和主动的转胞吞作用分离。结果发现,当阻断转胞吞途径后,AuNPs在肿瘤部位的富集量明显减少。进一步通过数据分析,经内皮细胞间隙渗漏进入肿瘤的AuNPs只占总数的3-25%(取决于AuNPs的粒径)。以上这些结果颠覆了早期人们对EPR效应的理解,极有可能影响后期纳米药物的设计思路。
2、对纳米药物发展瓶颈的新认知
这篇社论审视了纳米药物在临床应用上遇到的瓶颈,坦言传统的EPR效应机制受到了挑战。哈佛大学的David Mooney和Irene de Lázaro对该文进行总结,强调这些颠覆性的发现,并呼吁人们重新审视在纳米粒子传递机制方面建立已久的模式。

这不是EPR效应第一次受到争议,近年来,跨物种和肿瘤类型的血管系统异质性,以及肿瘤微环境其他参数的可变性,让人们对EPR效应产生怀疑。过去30年里,为癌症治疗开发的纳米药物层出不穷,设计越来越复杂。但到目前为止,只有10种纳米药物通过了FDA的审批,仅有14%的药物显示有临床疗效。研究表明,经系统给药后,仅有0.7%的纳米药物到达实体肿瘤。毫无疑问,纳米药物在癌症治疗中是有益的。作为化疗药物的载体,它们通过限制全身毒性,极大地增强了患者的耐受性。然而,令人遗憾的是,高流失率导致人们对纳米医学的效力产生了一些怀疑。纳米药物的疗效差主要是因为纳米粒子在肿瘤中的积累不足和药代动力学差。
作者的研究结果让人们注意到这个领域对肿瘤外溢机制的有限理解,以及对EPR效应的关注可能混淆了纳米药物的设计。其他的纳米颗粒参数,包括材料组成、几何形状、表面化学、电荷和机械性能等,都会影响其与生物屏障的相互作用,并可能影响其外渗作用的相对重要性和具体机制。
3、转胞吞作用于癌症纳米医学的新机遇
虽然作者的结果表明,转胞吞作用确实可以作为纳米粒子进入实体肿瘤的主导机制,但他们只研究了三种尺寸的AuNPs,EPR效应对15 nm、50 nm、100 nm的AuNPs在肿瘤富集的贡献分别为12%、3%和25%,这种趋势与通常的认知不符,因此,可能存在更为复杂的途径影响了50 nm粒子的EPR效应,有待进一步研究。
目前,关于胞吞作用的机制细节,以及触发纳米粒子在血管内皮内的细胞摄取、运输和释放的结构因素,我们知之甚少。有研究表明,受体-糖蛋白结合、电荷反转过程可以触发转胞吞作用。抗体、核酸、多肽甚至碳水化合物等大分子都可以附着在纳米颗粒表面进行选择性靶向和转运。伊利诺伊大学的聂书明和同事表示,这些发现应该激励研究人员开发利用主动转胞吞作用提高递送效率的技术,包括使用肿瘤穿膜肽、设计阳离子聚合物偶联物、允许吸附介导的主动胞吞作用等。
除了转胞吞,利用纳米技术增强免疫响应为肿瘤治疗提供了新思路。与设计需要克服血管内皮细胞屏障的纳米粒子相比,利用免疫细胞摧毁肿瘤更为有效。首先,只需要激活一小部分免疫细胞就能引起抗肿瘤免疫响应,而传统化疗等都需要向肿瘤输送大量药剂,造成严重的副作用。其次免疫治疗会产生免疫记忆,有效防止肿瘤复发,同时还能有效抑制肿瘤向远端转移。纳米粒子能够实现多种免疫药物的同时输送,通过多种机制诱导免疫反应,因此,利用纳米载体向肿瘤特异性输送免疫药物将会是一个很有前景的方向。此外,纳米粒子独特的光学性质可以与治疗性相结合,开发用于癌症免疫治疗的多模式药物载体。
4、专家建议
也许,正是人们对EPR效应的高估造成了纳米药物发展的瓶颈。为了理解纳米粒子与人体相互作用的基本原理,哈佛大学的David Mooney和Irene de Lázaro呼吁科学界应该将更多的注意力转向基础研究。该领域还应该与生命科学家和肿瘤学家进行更密切的合作,因为他们对肿瘤生物学和患者特异性有更好的认识。最终,为了在癌症纳米医学上取得进展,还需要更多大胆的研究来真正挑战现有的模式。
原文链接:
参考文献:
https://doi.org/10.1038/s41563-020-0676-x





