近期,天津大学化工学院仰大勇教授课题组在化学领域权威期刊Angewandte Chemie(德国应用化学)上发表关于手性碳量子点模拟拓扑异构酶I调控超螺旋DNA拓扑结构的研究,发现了手性碳量子点模拟拓扑异构酶的作用机制,阐明印证了生命系统中基因转录的部分分子机制。天津大学化工学院李凤副教授和博士研究生李帅为共同第一作者。合作者包括中科院生物物理所高利增研究员,天津医科大学刘阳平教授、宋玉光副教授和谈小莉博士。研究得到国家自然科学基金和科技部重点研发项目的资助支持。
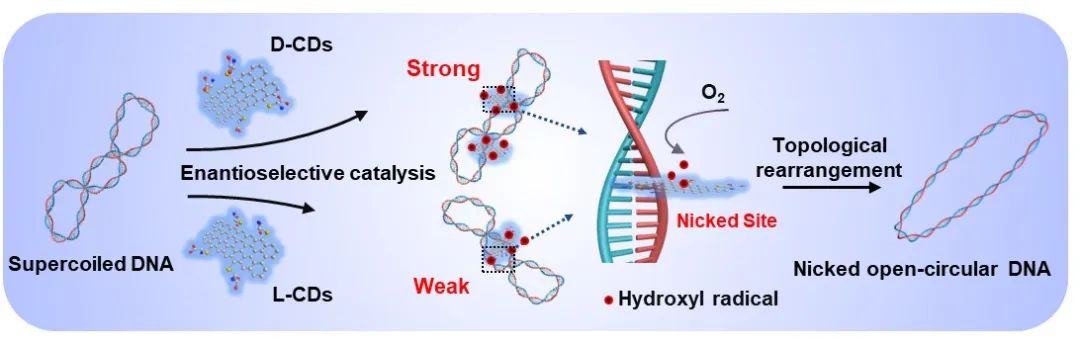
DNA是一种双螺旋结构的生物大分子,是生命系统的核心遗传物质,引导生物发育和生命机能运作。DNA的高级结构也称DNA拓扑结构,是指在DNA双螺旋的基础上,进一步扭曲所形成的特定空间结构。超螺旋结构是DNA拓扑结构的主要形式,超螺旋密度由DNA拓扑异构酶来调节和控制。DNA拓扑异构酶可通过催化DNA链的断裂和结合,从而控制DNA的拓扑结构,对于DNA复制转录等生命活动具有重要调控作用。其中,拓扑异构酶I可催化DNA双螺旋结构中单条DNA链的瞬时断裂和连接,且不需要能量辅因子如ATP或NAD。
仰大勇教授课题组发现以手性半胱氨酸为碳源合成的手性碳量子可模拟拓扑异构酶I实现DNA拓扑结构的调控,且调控作用表现出手性依赖的差异性:D-碳量子点(D-CDs)可有效地将超螺旋质粒DNA转变为具有缺口开环构象,L-碳量子点(L-CDs)催化的转化率则远低于D-碳量子点。机理研究发现手性碳量子可以嵌插入DNA双螺旋结构的碱基对之间,并有效催化活性氧的生成,从而造成单链DNA磷酸骨架的氧化断裂,DNA由超螺旋构象转变为开环构象。分子动力学模拟进一步证明,相对于L-半胱氨酸,D-半胱氨酸与DNA之间可以形成更多的氢键和更低的结合自由能,D-CDs相对L-CDs与DNA具有更强的结合力,从而表现出更高的催化活性和调控作用。
考虑到DNA的拓扑结构对其功能具有重要影响,作者在无细胞蛋白表达体系中,以可表达绿色荧光蛋白的质粒DNA(p-eGFP)为模型,研究了手性碳量子点处理后的超螺旋质粒DNA的蛋白表达功能。研究发现手性碳量子点处理后质粒仍可进行正常的绿色荧光蛋白表达,且蛋白产量和表达速率较对照组具有一定程度的升高。这一发现说明质粒DNA双螺旋的缺口对其转录过程几乎没有影响。在转录过程中,DNA双链在RNA聚合酶内部解旋,合成RNA后,RNA聚合酶沿着DNA双链往前移动,移出RNA聚合酶的DNA重新结合成双链结构,因此在整个转录过程中,DNA仍然保持完整的双链结构,而不会因为缺口的存在使其在转录过程中断裂。此外,作者推测由于缺口两侧的DNA可以自由旋转,不会在DNA转录过程中形成超螺旋,因此更加有利于转录过程的进行。
本研究揭示了碳量子的手性特征对其生物催化性能的影响,利用碳量子点对DNA构象的调控探索了DNA构象对其基因功能的影响和机理,对理解DNA构象关系和转录等生命过程具有重要启示,在基因编辑和蛋白质工程领域具有应用潜力。
原文链接:
https://www.onlinelibrary.wiley.com/doi/10.1002/anie.202002904


