光动力治疗是一种利用特定波长的光来激活光敏剂分子使其产生具有细胞毒性的活性氧物质来杀灭肿瘤细胞的方法。从它的定义可以看出,只有光敏药物分子聚集在肿瘤部位并进行光辐照才能实现治疗,所以光动力治疗具有非侵入性和高选择性,可以降低或者避免抗肿瘤药物分子对正常组织的毒副作用。
目前在临床上广泛使用的光敏剂主要是卟啉及其衍生物,所使用的激发光主要分布在紫外和可见光波段。我们知道生物组织本身对紫外可见光具有强烈的吸收作用,这样就会导致用于光动力治疗的光在到达治疗位点前大幅衰减,降低了光动力治疗的效率。为了实现对生长在较深组织处的肿瘤施行光动力治疗,我们需要考虑采用在生物组织中穿透能力更强的近红外光来激活光敏剂。
目前面临的挑战是,大部分高效光敏剂的吸收波长都比较短, 而具有近红外吸收的光敏剂的毒性活性氧产生效率又普遍比较低。双光子光动力是一种利用近红外光来激活光敏剂的方法。具有短波长吸收的光敏剂可以吸收两个近红外光子(约是光敏剂吸收波长的两倍)而被激发产生活性氧物质,为深层组织的肿瘤治疗提供了可能性。另一方面,基于光敏剂的非线性双光子吸收的固有属性,双光子激发可以对分布在肿瘤组织中的光敏剂在三维空间上进行精准激活,实现高效可控的精准光动力治疗。
双光子光动力的巨大优势和潜力已经引起了广泛的关注和研究,但是目前主要集中在利用近红外一区的光(700-950 nm)来激发吸收在短波长的光敏剂。近些年来,近红外二区光(1000-1700 nm)已经展现出比近红外一区光更好的组织穿透能力,实现了更大的成像深度。如果充分利用近红外二区光的穿透优势来激活光敏剂,可以进一步改善深层组织肿瘤的光动力治疗效果。能够被近红外二区的光进行双光子激发的光敏剂需要在长波段(500 nm以上)有强的吸收,但是目前高效率的光敏剂在长波段的吸收都比较弱。另一方面,大部分的光敏剂在生物环境中溶解性较差而容易发生聚集,分子聚集诱发的淬灭效应会进一步减弱光敏剂的荧光发射和活性氧产生能力。因此,实现光敏剂在吸收红移的同时又保证具有高效的活性氧产生能力非常具有挑战性。
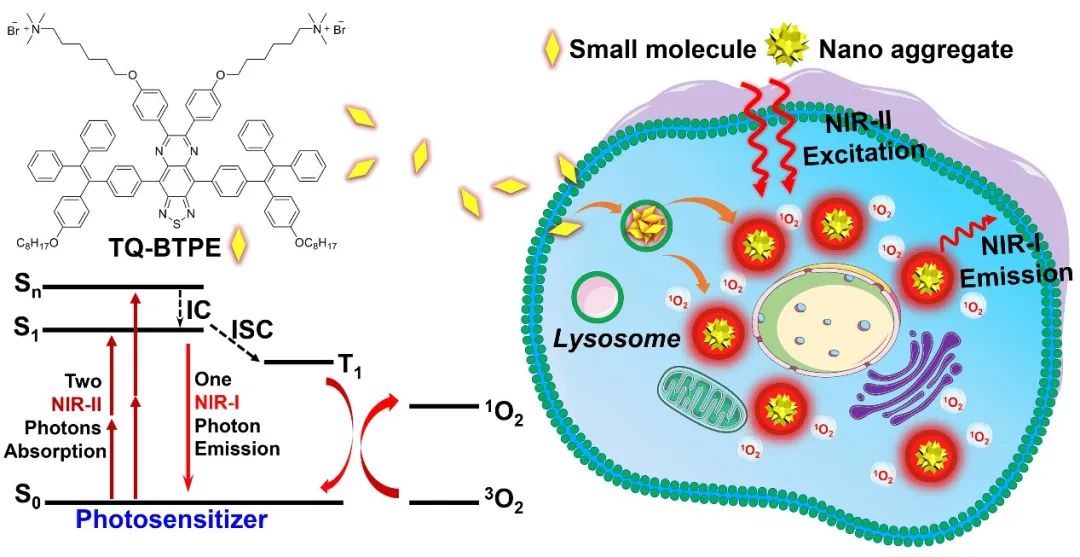
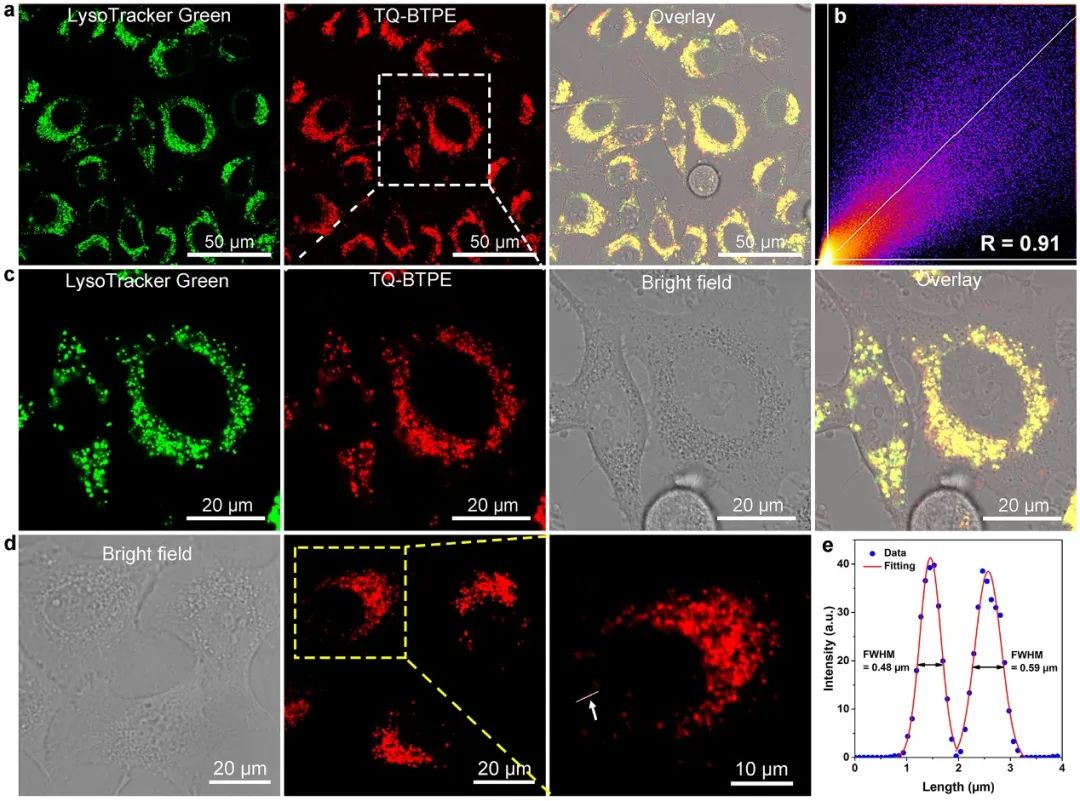
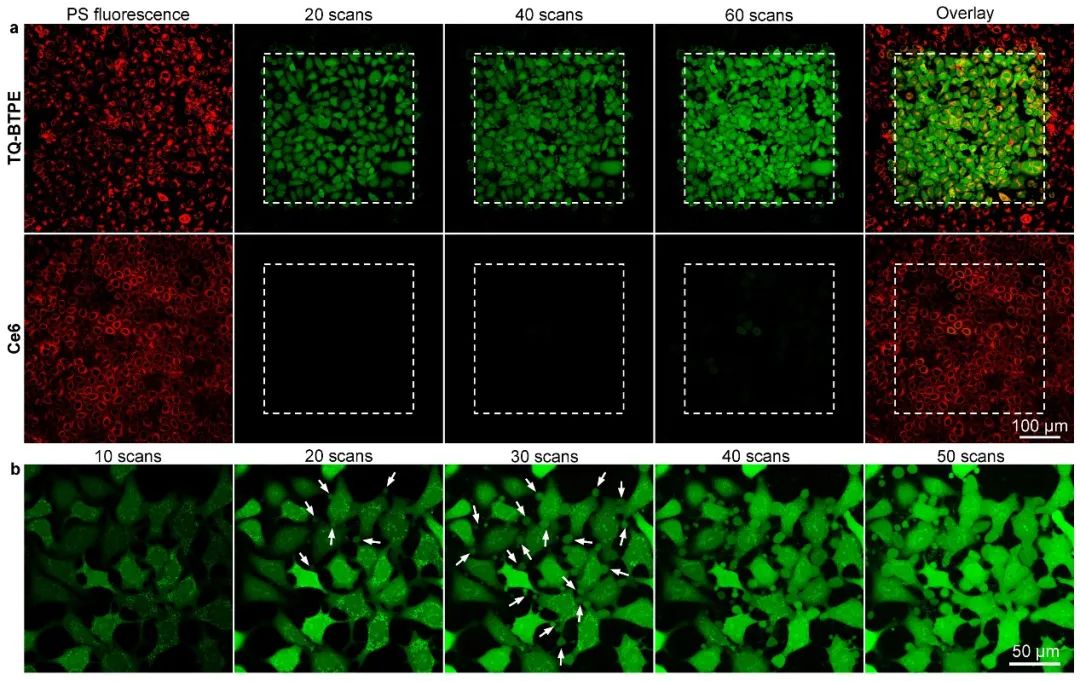
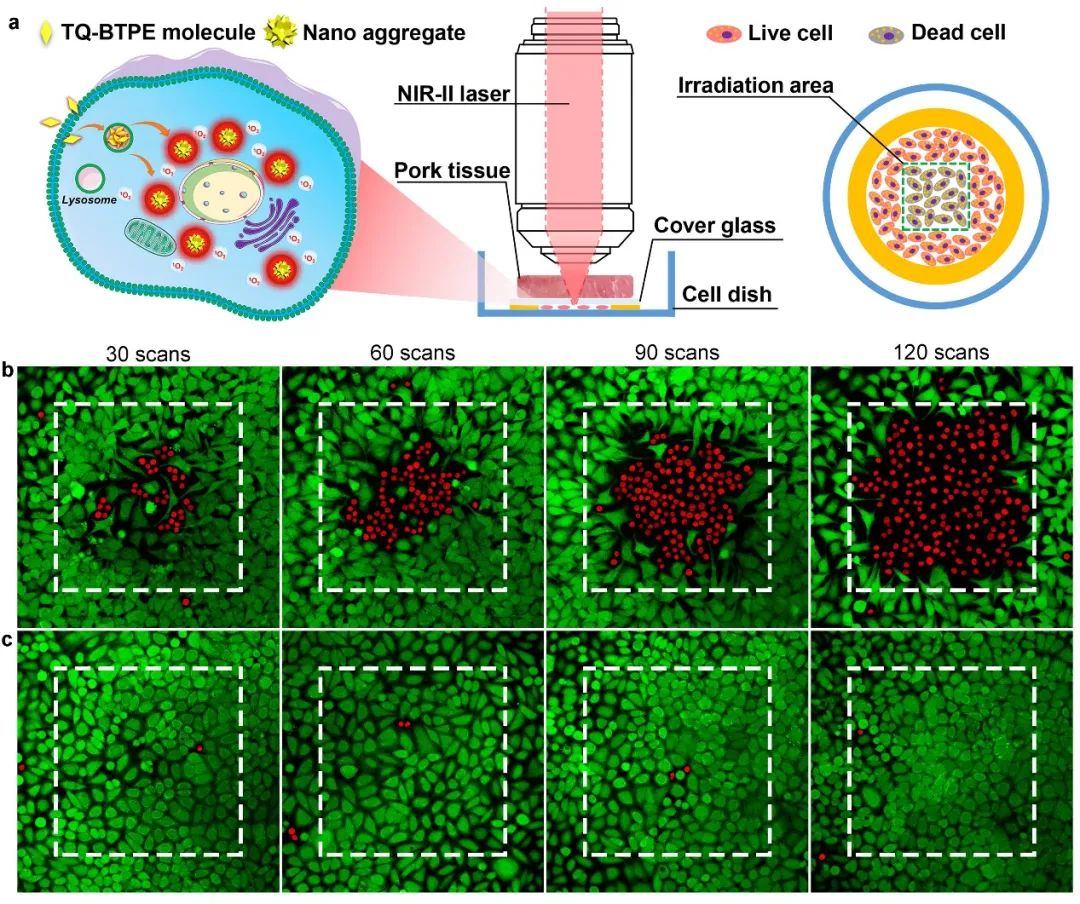
近日,新加坡国立大学刘斌教授课题组在Wiley旗舰期刊《Advanced Functional Materials》报道了近红外二区光激活的有机光敏剂,并且实现了精准高效的双光子光动力治疗(图1)。课题组通过利用低带隙的基团TQ作为强电子受体(acceptor)设计了具有给体-受体结构的光敏剂TQ-BTPE。这种结构不仅实现了吸收红移,而且分子内的强电子转移有助于增强双光子吸收。同时,为了减少分子聚集诱发对活性氧产生的淬灭效应,引入两个具有扭曲结构的TPE基团作为电子给体(donors),使得TQ-BTPE成为具有聚集诱导发光(aggregation-induced emission,AIE)性质的光敏剂。TQ-BTPE在长波段(550-600 nm)有较强的吸收,并且在近红外二区(1200 nm)有较高的双光子吸收。在近红外二区光激发下,TQ-BTPE的双光子光敏效率是目前广泛使用的商业光敏剂Chlorin e6的7倍。当TQ-BTPE分子在被癌细胞摄取之后主要以纳米聚集体的形式分布在溶酶体中(图2),在近红外二区光辐照下细胞内产生大量的活性氧物质(图3),最终这些活性氧实现了高效率的癌细胞杀灭效应(图4)。与此同时,文章中通过模拟生物组织比较了近红外一区和二区的光在组织中的穿透能力和双光子光敏效率,证明了近红外二区光具有更深的组织穿透能力和更好的双光子光动力治疗效果。这项研究为开发近红外光可激发的高效光敏剂提供了新见解。