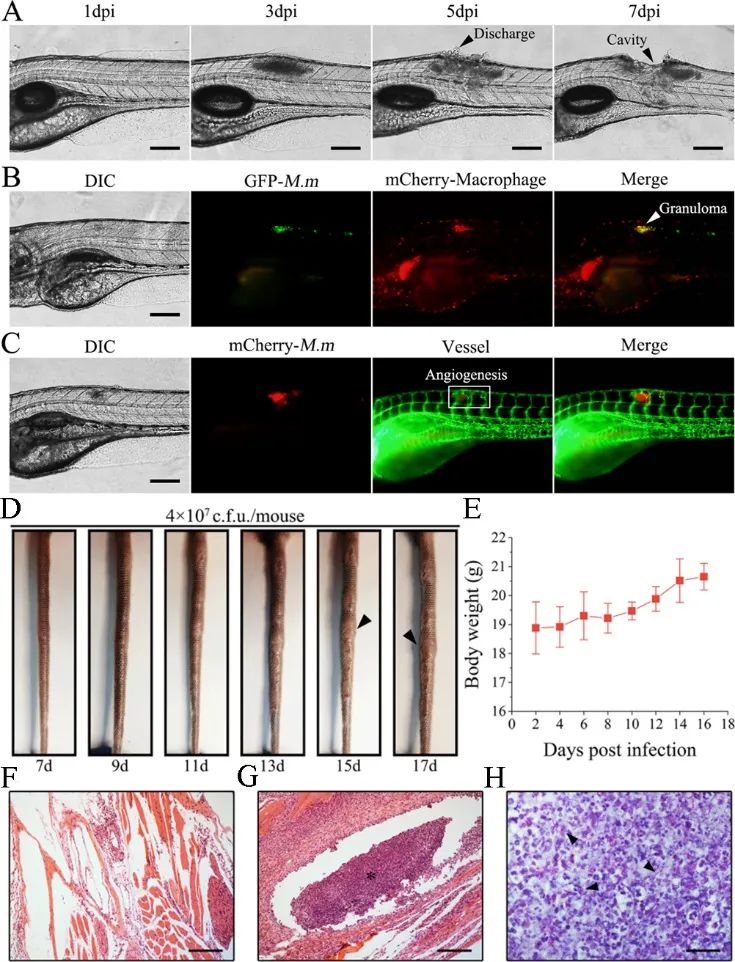
结核病(Tuberculosis,TB)是结核分枝杆菌(Mycobacterium tuberculosis,M.tb)感染引发的单病原体致死人数最多的传染病。结核结节(Granuloma)作为TB的特征性结构,主要由大量巨噬细胞和其他免细胞紧密排列而成,包绕着“中央坏死区”,内含大量M.tb和与之对抗而死亡的巨噬细胞碎片。结核结节对人体来说是一把“双刃剑”,一方面,结核结节的致密结构能够有效隔离M.tb,防止细菌向外扩散;但是,当人体免疫力下降时,结核结节内的M.tb会再次大量活化和增殖,引发活动性TB。另一方面,结核结节的致密结构及坏死组织,严重限制了抗生素进入,致使临床常规的联合用药治疗方案疗效差、疗程长、毒副作用大,从而导致患者依从性差及结核病的迁延不愈。
考虑到结核结节与实体肿瘤病理结构的相似性,中山大学附属第五医院黄曦教授团队发现,结核结节同样具有“高渗透性和滞留效应”(EPR效应),纳米颗粒能靶向并滞留于结核结节。据此,他们采用新型聚集发光(AIE)材料、抗结核药物利福平(RIF)、双亲性胶束分子(DSPE-PEG2000),构建了一种基于聚集发光的多功能载药纳米胶束。AIE材料发射强烈荧光实现结核结节的靶向成像和追踪;AIE材料在激发光作用下产生大量活性氧ROS;实现结核菌的光动力杀伤;纳米胶束包裹的RIF实现结核病的靶向协同化疗。因此,纳米胶束兼具靶向成像、光动力治疗及化疗功能,实现结核病的多模态精准诊疗。
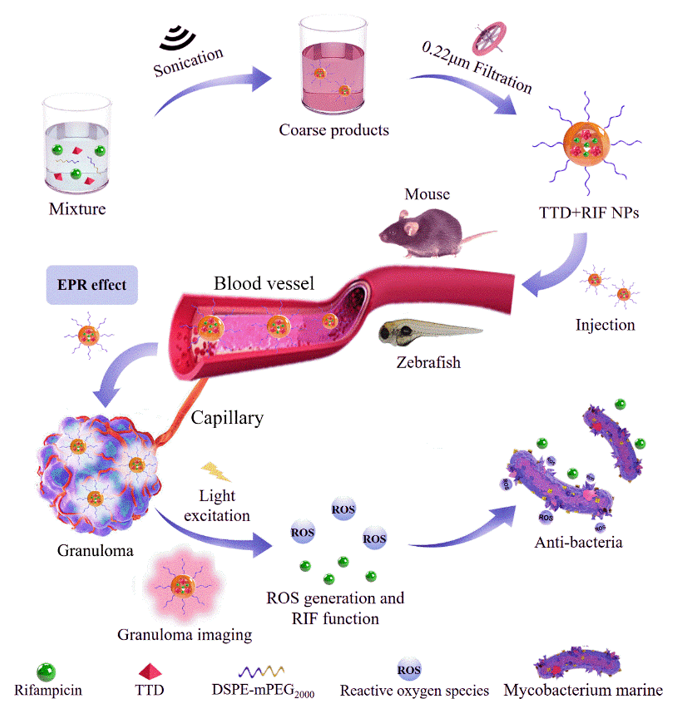
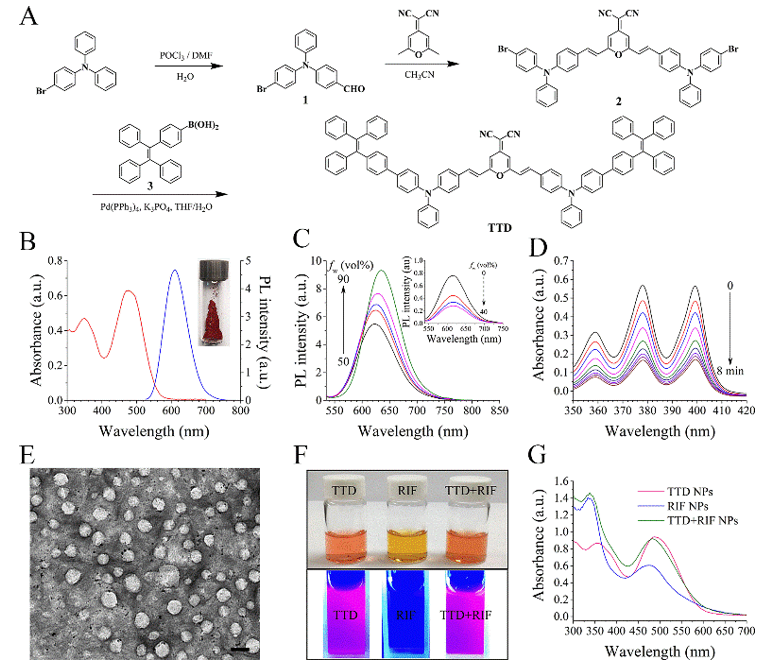
纳米胶束内的新型AIE材料TTD具有发射强烈红色荧光、聚集发光和产ROS特性。球型纳米胶束TTD+RIF NPs的粒径为~120 nm,其包裹了抗结核药物RIF,从而实现结核菌的协同药物杀伤。
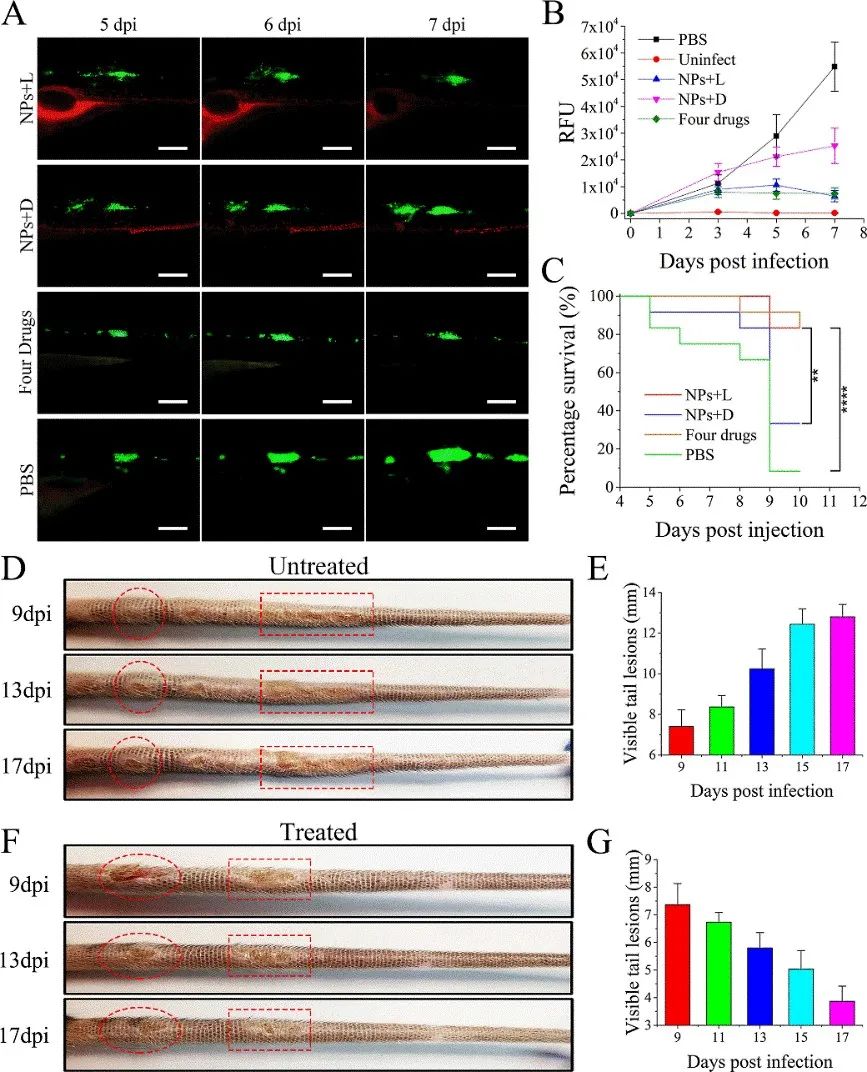
静脉注射TTD+RIF NPs到海分枝杆菌感染导致的两种结核结节的动物模型体内后,TTD+RIF NPs会通过EPR效应靶向结节,实现单个结节的靶向成像和长期靶向追踪。
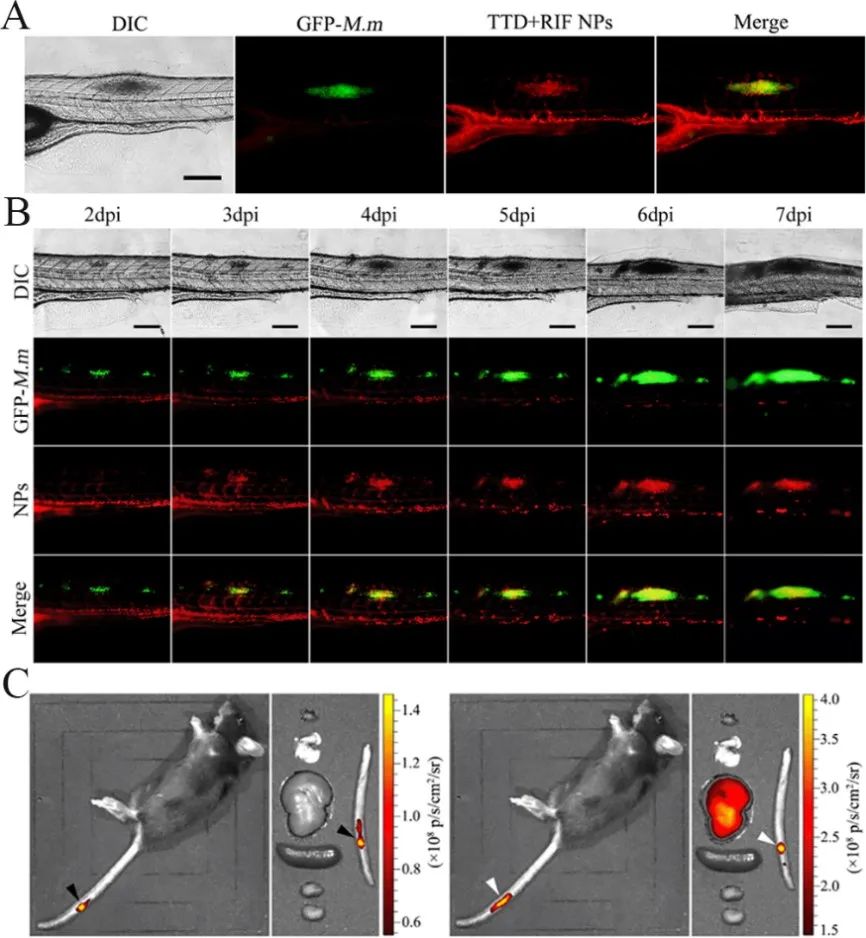
同时,TTD+RIF NPs能够显著杀伤斑马鱼结节内部的海分枝杆菌,斑马鱼生存率大大提高;并且,TTD+RIF NPs能够显著抑制小鼠尾部的结节损伤。
基于聚集发光的多功能纳米胶束TTD+RIF NPs的纳米载药体系,可以实现单个结核结节的靶向成像和追踪,并能有效杀伤结节内部的结核菌,为实现结核病精准诊疗提供新的思路。
参考文献:
Liao, Y.; Li, B.; Zhao, Z.; Fu, Y.; Tan, Q.; Li, X.; Wang, W.; Yin, J.; Shan, H.; Tang, B. Z.; Huang, X., Targeted Theranostics for Tuberculosis: A Rifampicin-Loaded Aggregation-Induced Emission Carrier for Granulomas Tracking and Anti-Infection. ACS Nano 2020.
全文链接:
https://pubs.acs.org/doi/10.1021/acsnano.0c00586