糖尿病是一种常见的慢性病,个性化精准治疗是极具吸引力的。精确控制剂量对药物疗法至关重要。在概念验证研究中,植入封装设计工程细胞来微调蛋白治疗剂的原位生产和系统递送,以响应化学和物理信号。基因表达或囊泡分泌电刺激需要生物电界面来管理电极和电敏设计细胞之间的电传导,以及通过去极化将电子信息转换为蛋白质的产生和释放。随着遗传学的出现,可以使用智能手机控制遗传学生物医学植入物,以上传设计细胞的指令,产生并全身递送治疗剂量的胰岛素生成肽的方法,进而控制血糖。血糖水平的调节是一个闭环恒定过程。胰腺β细胞释放的胰岛素涉及葡萄糖的吸收和代谢,三磷酸腺苷介导的钾通道的封闭,质膜的去极化以及电压门控钙通道的开放,将导致细胞内Ca2 +激增并同时从细胞内储泡中快速释放胰岛素以达到治疗。
【研究成果】
近日,苏黎世联邦理工大学合成生物学大师Martin Fussenegger教授团队,华东师范大学叶海峰研究员(优青) 和西湖大学解明岐研究员等研究者们共同合作,提出了一种无辅因子的生物电子界面理论,该界面连接了人无线电刺激的人体细胞和人工合成的启动子驱动的转基因表达,或使囊泡储藏库内快速分泌表达蛋白治疗。电遗传学控制通过耦合L型电压门控通道CaV1.2的异位表达,和向内整流钾离子通道Kir2.1的所需输出来实现。针对I型糖尿病,他们设计了电敏感的人类β细胞,定制生物电子设备内部的β细胞可无线电刺激实时控制囊泡胰岛素的释放,胰岛素可在10分钟内达到峰值。结果表明,当植入皮下时,这种电触发的囊泡释放系统可恢复1型糖尿病小鼠的正常血糖。这项研究以题为“Electrogenetic cellular insulin release for real-time glycemic control in type 1 diabetic mice”的论文发表在国际顶级期刊《Science》上(下附原文链接)。同时,该文也被特别转载在其新闻栏以题为“Remote activation of cellular signaling”。
【图文解析】
1. 生物电子植入物的设计:
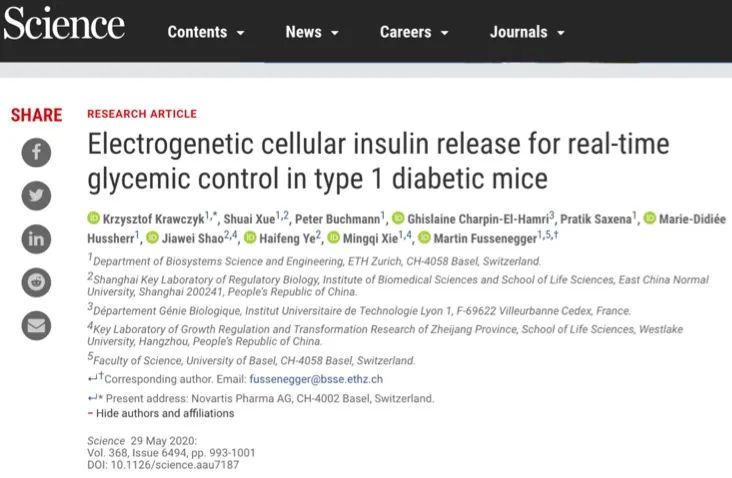
该文将电刺激的基因表达转换为临床概念验证的生物电子植入物,需要对电极和电刺激进行更紧凑的设计。在转录控制装置中,简单小型化的自由悬挂电极不能提供有效的电刺激。因此,作者设计了一种定制细胞工程培养插入物,该插入物在半透膜的每一侧都包含电极,该电极具有单层电敏ElectroHEK细胞(图3A)。在较短的脉冲长度下,对pMX57(PNFAT3-SEAP-pA)转染的ElectroHEK细胞进行电刺激,会导致7.5 V的碱性磷酸酶(SEAP)峰值水平(图3,B和C),这比以前的自由悬挂电极排列低一个数量级。(图3,D和E)。
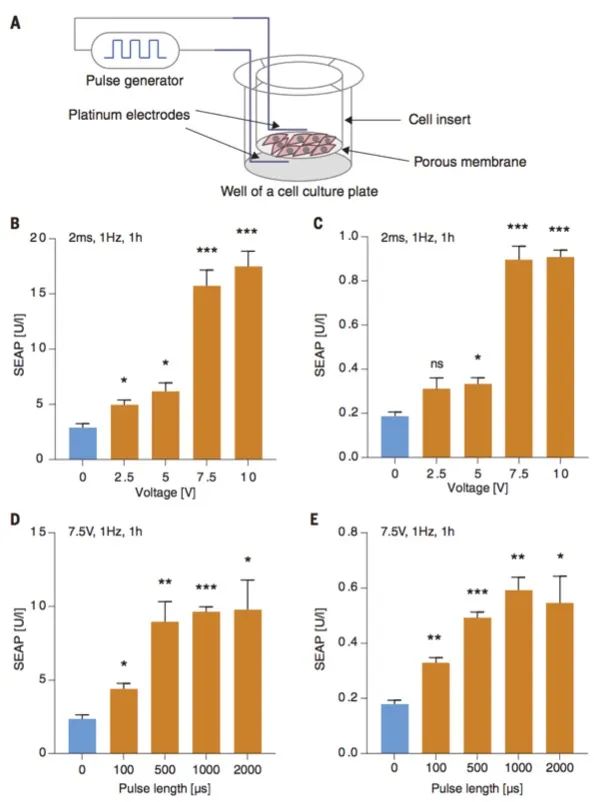
为了使体内电敏细胞能够电刺激转基因表达,作者还设计了一种无线生物电子植入物。将定制的装有电极的细胞培养插入物点击进入3D打印的FDA许可的聚酰胺外壳(图4,A和B),该电子开关盘产生方形单极脉冲。生物电子植入物的对照运行验证了pMX57转染的ElectroHEK细的无线电刺激控制SEAP表达(图4C)。
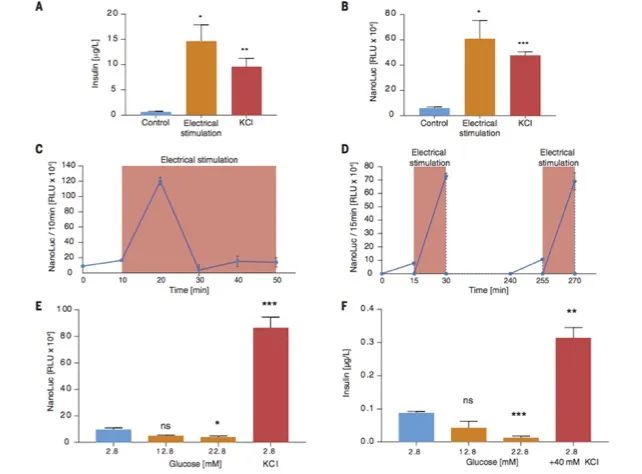
2. 电β细胞提供电刺激的囊泡分泌:
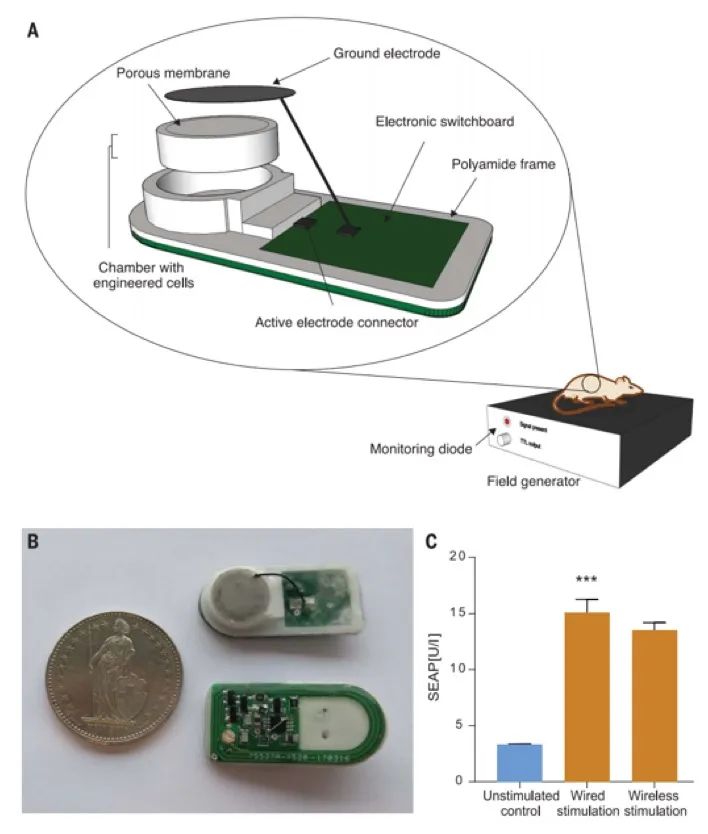
为了使电刺激胰岛素囊泡释放的哺乳动物细胞工程化(图5A),作者通过选择葡萄糖敏感的缺点(图6,E和F),从胰腺β细胞系1.1E7衍生了一个单克隆种群INSVesc。,但保留了囊泡胰岛素分泌机制。实际上,Electroβ细胞的电子显微照片是一种稳定转基因CaV1.2和Kir2.1通道组成型表达的INSVesc转化(pKK66,PhEF1α-α1C-P2A-Kir2.1-pA; pMX251,PhEF1α-α2/δ1-P2A- β3-pA)和Proinsulin-NanoLuc(一种设计构建体,可在内分泌细胞类型中以等摩尔比共分泌胰岛素和Oplophorus gracilirostris荧光素酶(NanoLuc)(图5A),显示出让人联想到人胰岛来源的β细胞的含胰岛素颗粒(图5,D和E)。另外,Electroβ细胞响应于KCl介导(图5,B和C)或电刺激(图6,A和B)膜去极化,显示出良好相关的囊泡胰岛素和NanoLuc分泌。
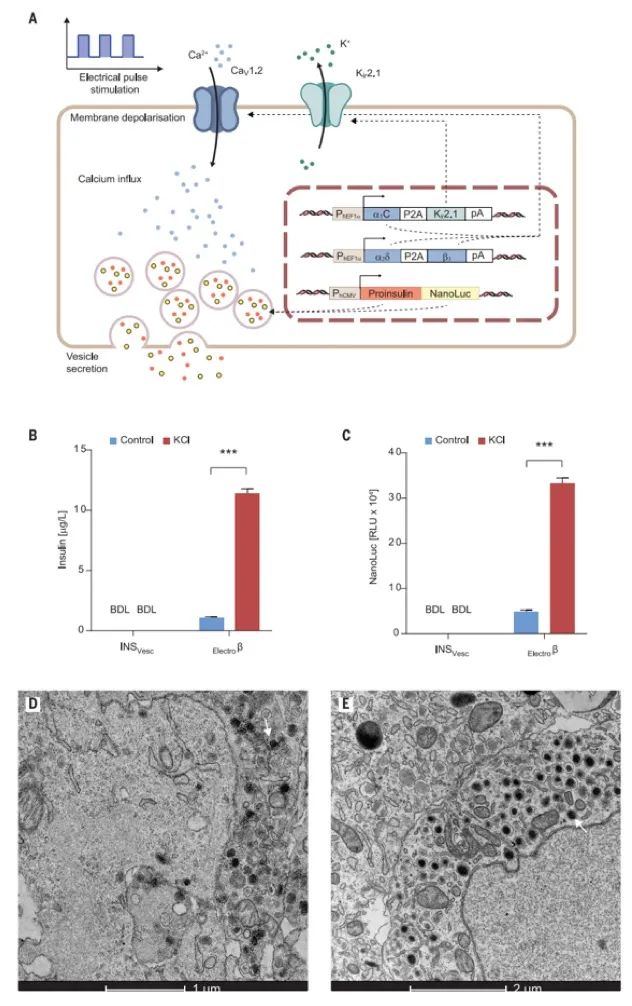
作者通过电刺激Electroβ细胞并记录培养物上清液中相应的NanoLuc介导的发光来描述基于去极化的胰岛素释放动力学(图6C)。电刺激后,10分钟内达到NanoLuc峰值水平(图6C)。最重要的是,Electroβ细胞未显示任何葡萄糖敏感性胰岛素的产生,从而确保了电刺激控制囊泡胰岛素分泌,而不受血糖水平的干扰(图6,E和F)。
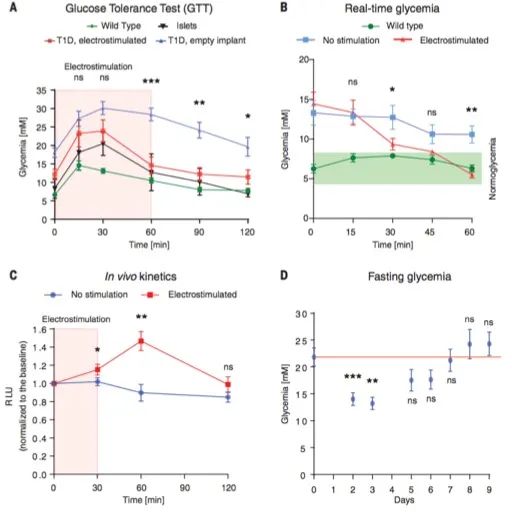
3. 无线电刺激的胰岛素囊泡分泌可在1型糖尿病小鼠中提供快速的血糖控制:
从储存库中释放胰岛素可以改善反应动力学,并在餐后迅速恢复血糖稳态。到目前为止,用于治疗实验性糖尿病的设计都是基于细胞的概念验证策略,集中于转录控制,转录控制被认为太慢,无法应对餐后血糖激增。对于OptoHEK细胞,观察到了相似的性能。相反,当置于无线生物电子植入物中时(图4),Electroβ细胞可以在短暂的电刺激后在胰岛素缺乏型1型糖尿病小鼠中重建餐后葡萄糖代谢,而不会引起降血糖偏移(图7A),并且可能迅速降低电刺激后血糖水平恢复正常血糖(图7B)。值得注意的是,电刺激仅在1小时后显示峰值信号,在2小时后恢复到基线(图7C)。还可以在更长的时间内控制血糖,而没有任何低血糖的迹象(图7D)。
【陈述总结】
该文通过生物电子植入物内部的电敏设计器,细胞能以无线电方式刺激胰岛素释放,与此同时能够迅速恢复I型糖尿病小鼠的正常血糖。作者采用分泌途径或囊泡分泌对生物药物释放进行编程的无线电子设备,并通过设备与植入细胞之间的直接通信,推进了遗传学的方法,有望为针对个人优化的先进精密医疗保健打开许多新的机会。