心肌梗塞是冠状动脉急性、持续性缺血缺氧所引起的心肌坏死。多数患者在起病前1-2周,有活动后胸骨后闷痛不适。但是,目前在治疗心肌梗塞方面还存在一些问题。纳米纤维素与细胞外基质(ECMs)相似,具有生物相容性,可以组装成高度多孔的结构,在生物医学领域被广泛应用。此外,纳米纤维素的水悬浮液是无毒且高度稳定的,并且与成纤维细胞、H9c2心肌成肌细胞和小鼠前成骨细胞(MC3T3-E1)细胞相容。而聚(癸二酸甘油酯)(PGS)是生物医学器件中常用的可生物降解且具有成本效益的聚合物,与纳米纤维素结合可以改变其机械性能,特别是使支架具有弹性和柔性。基于此,芬兰阿尔托大学的Orlando J. Rojas和赫尔辛基大学的Hélder A. Santos(共同通讯作者)等人报道了一种包含纳米纤维素、聚癸二酸甘油酯(PGS)和聚吡咯(PPy)的生物材料系统,用于治疗心肌梗塞。作者利用直接墨水书写的多组分水性悬浮液可以形成多功能晶格结构,这种结构不仅具有弹性和导电性,而且还能促进细胞生长。鉴于其与H9c2心肌细胞的生物相容性,它们被作为心脏贴片,后者在微观结构水平上广泛附着,并诱导其增殖28天。文中研究了两种模型药物(3i-1000和姜黄素)在贴剂中的整合,通过将其装入用于挤出的前体悬浮液中,或者直接浸渍所获得的干燥晶格。在5个月的药物释放研究中,观察到心脏贴片的体外降解缓慢,可以防止药物快速释放,因此其适用于长期治疗。此外,通过生物相容性、生物降解性、机械强度、柔性和电导率的结合,符合高度动态和功能性电响应心脏组织的要求。总之,通过心肌细胞与生物材料的有效整合,提出的心脏贴片可以作为心肌梗塞后心肌再生的可行替代品。
【图文解析】
首先,作者测试了2, 2, 6, 6-四甲基哌啶-1-氧基自由基氧化的纳米纤维素(TOCNF)、PGS前体分子(pre-PGS)和PPy,以提供合适的剪切流动行为,并赋予贴片机械完整性和导电性。其中,TOCNF用作pre-PGS和PPy的主要成分和支撑相,将其添加以提供弹性和导电性。3D打印的贴片包含超过95%的溶剂,导致干燥时大幅收缩。为了限制这种影响,作者将样品冷冻干燥,以保留结构及其孔隙度,接着在真空烘箱中于120 oC下将PGS固化(不超48 h)。冷冻干燥后,贴片分别经历5%和14%的收缩,在分别进行预PGS固化(真空炉)。

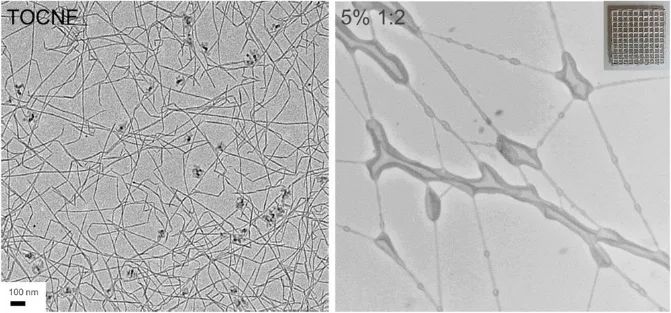
作者利用透射电子显微镜(TEM)揭示了纤维素纳米原纤维(TOCNF)的形态,显示了较高的轴向尺寸(图2)。利用3D打印将纳米纤维素、pre-PGS和PPy组成的阳离子混合物形成界面带静电的复合物。在高温和真空下固化后,PGS组件赋予基于TOCNF的系统弹性。基于纳米纤维素的支架显示出相互连接的孔,这些孔可以促进细胞生长和相互作用(图3)。对比PGS-PPy或多组分对应物,单组分TOCNF支架的多孔性明显好(94±1%孔隙率)。总之,TOCNF增强了结构的孔隙率和渗透性,有利于细胞附着。在PGS预先固化后,各相形成具有78±2%孔隙率的均质生物复合结构。

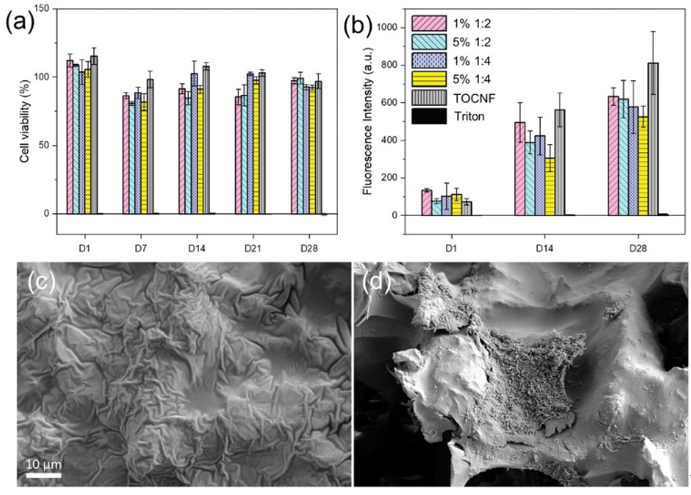
接着,作者检查了可降解贴片的生物相容性。如图5a所示,不同贴片的降解性不影响H9c2心肌母细胞的生存能力。在28天内未检测到细胞毒性,在第一天时甚至观察到了细胞的轻微增殖。如图5b所示,3D打印生物复合材料的所有类型均具有容纳心肌母细胞进行增殖的能力。通过空的对照样品和细胞毒性实验,表明其基本无毒,并显示了H9c2心肌母细胞与导电的贴片在细胞浸润后具有正向相互作用。TOCNF和PGS的亲水性、高孔隙率和表面积使该系统适用于细胞附着,同时保持存活率。
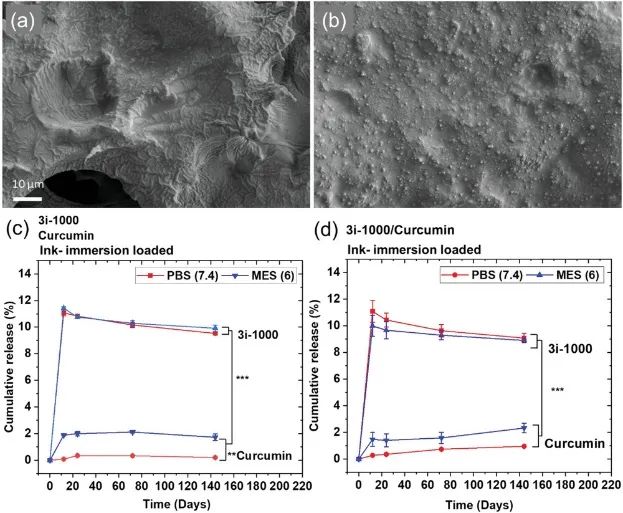
最后,在墨水和浸泡加载后,作者确定了两种被测试的模型药物的复合贴片的释放曲线。其中,姜黄素被用作抗氧化剂和抗炎剂,而3i-1000是GATA4 NKX2 5相互作用的抑制剂,并用于损伤后的心肌修复。两种药物都是疏水性的,且在pH=7.4和6时,表面带有负电荷。结果表明在所有测试条件下,姜黄素和3i-1000的累积释放量分别小于2%和12%。PGS-TOCNF-PPy贴片显示模型药物的缓慢释放,在21天后仅降解了8%。
【小结】
综上所述,在本文中,作者利用3D打印技术制备了负载药物的导电贴片,用于治疗心肌梗塞。在不需要交联剂的情况下,将多孔纳米纤维素、弹性PGS和导电PPy掺入生物复合物中。心脏贴片显示出与心肌母细胞的高度生物相容性,并诱导了28天的细胞增殖。附着在微结构上的细胞与微结构支架上的细胞具有相同的形状和样式。心脏贴片的缓慢降解有望防止心肌破裂释放,使其适合心肌梗死后治疗药物的长期协同传递。
全文链接:
https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202003440


