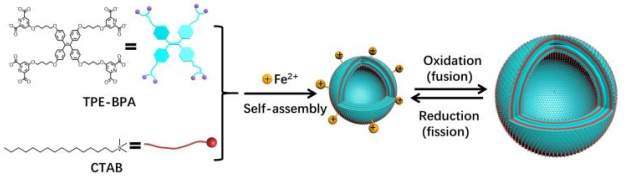
外泌体是指与细胞间信号传导和物质转运密切相关的纳米级胞外囊泡。细胞间通讯过程中通常涉及一个细胞释放新囊泡的分裂过程和另一个细胞吞噬的融合过程,而这两个过程在活细胞器中通常是可逆和可控的。然而,由于外泌体的复杂组成和细胞环境,关于融合和分裂过程的膜行为的知识及其调控因素仍然很少。这一障碍激发了具有与外泌体相似结构和分裂融合行为的人工囊泡的发展。
最近,唐本忠院士和深圳大学王东副教授、北京大学阎云研究员在《Angewandte Chemie International Edition》上发表了题为“Exosome-Mimetic Supramolecular Vesicles with Reversible and Controllable Fusion and Fission”的通讯,提出了具有氧化还原调节的可逆融合-分裂功能的人工超分子囊泡。这些囊泡在氧化时趋向于融合在一起形成大尺寸的囊泡,通过还原大囊泡分裂回到小尺寸的囊泡。超分子构建块的聚集诱导发射(AIE)特性使荧光技术能够监测囊泡转化过程中的分子构型。此外,所提出的囊泡是将siRNA转移到癌细胞的极好的纳米载体。
图1 仿外泌体囊泡的结构及其可逆和可控的融合-分裂行为示意图。
通过AIE活性分子TPE-BPA、十六烷基三甲基溴化铵(CTAB)和Fe2+离子的自组装构建了Fe2+配位囊泡。TPE-BPA是一种带负电荷的四臂分子,在聚集态表现出强烈的荧光发射。它能够通过离子相互作用与八个带正电荷的CTAB分子结合,自发地自组装成中性荧光囊泡。TPE-BPA还带有配位头,使TPE-BPA@CTAB超分子囊泡能够与许多金属离子配位,如Fe2+和Fe3+。囊泡状结构可能具有多层结构,其中TPE-BPA作为膜的骨架。Fe2+@囊泡的平均半径为25nm,而Fe3+@囊泡为54nm。
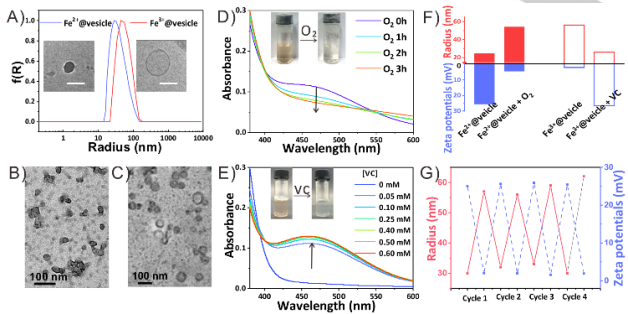
图2 (A) Fe2+@囊泡以及Fe3+@囊泡的DLS结果。插图是Fe2+@囊泡以及Fe3+@囊泡。比例尺为100 nm。(B)染色Fe2+@囊泡和(C)Fe3+@囊泡的透射电镜图像。(D)Fe2+@囊泡暴露于O2和(E)Fe3+@囊泡加入VC时的紫外光谱。(F) Fe2+@囊泡暴露于氧气和Fe3+@囊泡加入VC的半径和Zeta电位变化。(G) Fe2+@囊泡在交替添加VC和O2后的可逆尺寸和荷电状态变化。
氧化还原处理实现囊泡可逆转化。向Fe2+@囊泡中通入氧气,462nm处的紫外吸收(这是Fe2+与TPE-BPA配位基团之间的特定配位特征)逐渐降低,Zeta电位从25mv下降到5mv,同时囊泡半径从25nm增加到54nm。证明了Fe2+@囊泡转化为Fe3+@囊泡。另一方面,加入还原性维生素C,Fe3+@囊泡在462nm处紫外吸收逐渐增加,表明Fe2+和TPE-BPA之间出现配位现象。同时,所生成囊泡的Zeta电位、囊泡的大小和形态都与Fe2+@囊泡相同。
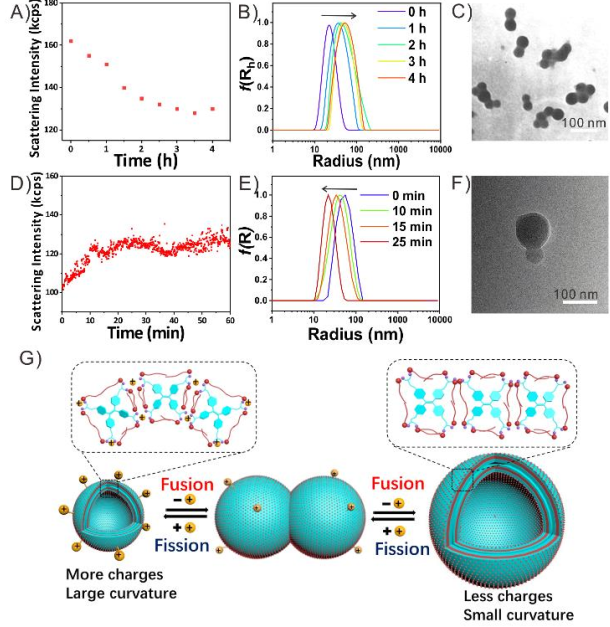
图3 Fe2+@囊泡暴露于氧气中(A)实时散射强度变化和(B)尺寸分布。(C)Fe2+@囊泡氧化后融合行为的TEM图像。Fe3+@囊泡与VC反应后(D)实时散射强度变化和(E)尺寸分布。(F)Fe3+@囊泡还原后分裂过程的TEM图像。(G)可逆和可控融合和分裂行为的可能机制示意图。
可逆和可控的融合和分裂行为的可能机制:在Fe2+@囊泡中,由于Fe2+离子配位产生的正电荷的强静电排斥作用,TPE-BPA分子趋向于相互排斥并堆积成松散状态。因此囊泡的膜曲率较大,半径较小。当Fe2+被O2氧化成Fe3+时,由于Fe3+离子大部分被水解,生成的水合物的配位能力可忽略,正电荷和静电斥力急剧减弱,形成囊泡膜的致密堆积。因此,囊泡融合在一起,降低了它们的相互作用自由能,形成了曲率较小的大尺寸囊泡。相反,加入VC后,Fe3+及其水合物转化为Fe2+离子,对囊泡具有良好的配位能力。静电斥力的增加会引起囊泡的分裂,进而产生具有大曲率的小尺寸囊泡。
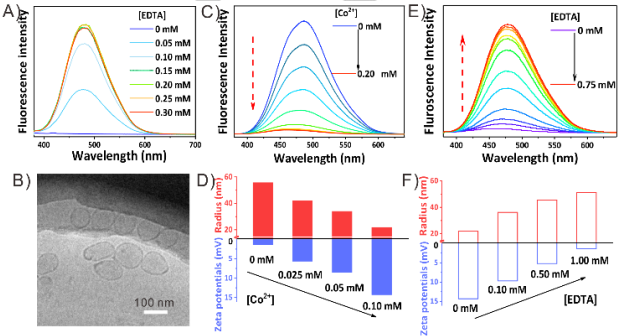
图4 (A)Fe2+@囊泡加入EDTA的荧光光谱。(B) Fe2+@囊泡加入0.25mM EDTA的低温透射电镜图像。(C)随着Co2+浓度的增加,囊泡的荧光光谱和(D)Zeta电位半径的变化。Co2+@囊泡逐步加入EDTA的(E)荧光光谱和(F)Zeta电位半径变化。
利用AIE分子的荧光发射,实现囊泡转化过程中分子堆积结构的实时监测。由于Fe2+和Fe3+离子都会使荧光猝灭,因此采用Co2+离子进行评价。Co2+离子的逐步添加导致囊泡尺寸减小和Zeta电位增加,对应于电荷引起的分裂过程。同时,荧光发射逐渐减少和蓝移。表明了AIE分子在分裂过程中呈现出越来越扭曲的形态,并松散地堆积在一起。相反,当EDTA被添加到Co2+@囊泡中去除膜中的电荷,囊泡的增大和Zeta电位的减小,意味着囊泡融合。此外,荧光发射逐渐增强和红移,表明AIE分子在融合过程中变得更加密集。
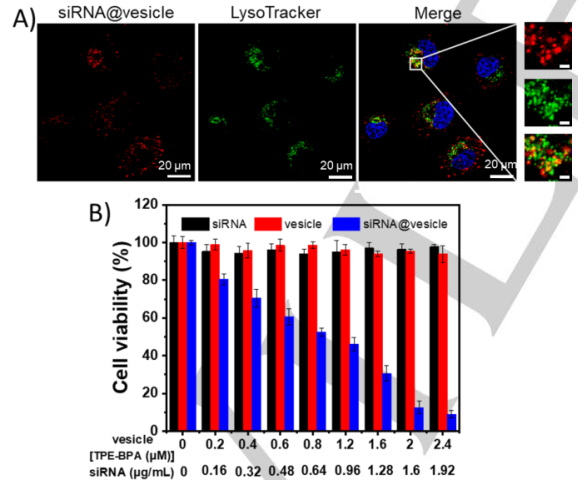
利用仿外泌体囊泡进行药物输送。siRNA是最有前途的肿瘤治疗药物之一。当siRNA加入到Fe2+@囊泡溶液中,Zeta电位降低,这表明siRNA与囊泡结合。siRNA通过siRNA@囊泡的细胞内吞作用被HeLa细胞有效地摄取,然后释放到细胞质中。这可能是由于癌细胞的细胞内氧化环境所致,细胞吞噬的Fe2+@囊泡被癌细胞内丰富的H2O2氧化为Fe3+@囊泡,从而导致正电荷的减少,削弱了与siRNA的相互作用。
图5 (A) Hela细胞与siRNA@囊泡孵育4 h后的共定位图像。用Cy5标记SiRNA(红色发射),溶酶体用LysoTracker染色为绿色发射,细胞核用Hoechst染色为蓝色发射。放大图片中的比例尺为2μm。(B)Hela细胞中游离siRNA、囊泡和siRNA@囊泡的细胞存活率。囊泡中TPE-BPA、CTAB和Fe2+的摩尔比为1:8:2,用TPE-BPA浓度计算囊泡的浓度。
亮点小结
作者成功地制备了一个具有可逆的融合和分裂行为的仿外泌体囊泡。当Fe3+的被氧化成Fe3+,由于Fe3+离子的水解降低了它们的配位能力,使囊泡的正电荷被去除。因此,囊泡趋向于融合在一起,形成大尺寸的囊泡以降低自由能。相反,当Fe3+还原为Fe2+时,电荷恢复,静电斥力增强,通过分裂过程形成小尺寸的囊泡。此外,利用囊泡构建块的AIE特性,可以监测囊泡转化过程中的分子堆积状态。这项研究将为外泌体的融合和分裂行为提供创新性的理解。另外,与传统的“分解”释药方式不同,仿外泌体囊泡通过融合过程释放载药siRNA,为药物释放系统提供了新的候选方案。
全文链接: