癌症作为世界范围内威胁人类健康的重要疾病之一,已引起研究者的高度重视。在过去几十年取得的众多进展中,癌症治疗学巧妙地将精确诊断与靶向治疗整合到一个空间共存的单一平台上。与传统的小分子制剂相比,纳米治疗平台在实现治疗效率最大化和脱靶毒性最小化方面具有巨大潜力。以前开发的治疗系统显示出各自和共同的缺点,包括诊断成像质量不佳、治疗负载和储存稳定性低、内在成分的毒性和不可降解性以及生产复杂性。鉴于具体情况,探索具有良好生物相容性、良好的诊断影像学和治疗效果的多功能纳米治疗平台已成为肿瘤治疗的迫切需求。
最近,唐本忠院士和深圳大学王东副教授在《Advanced Materials》上发表了题为“Aggregation‐Induced Emission Luminogens Married to 2D Black Phosphorus Nanosheets for Highly Efficient Multimodal Theranostics”的通讯,他们受聚集诱导发射(AIE)活性光敏剂和黑磷纳米材料在癌症治疗中各自优势的启发,展示了与二维黑磷纳米片结合的新型AIE光敏剂的简易构建及其在多模式治疗中的应用。所开发的纳米材料同时具有优异的稳定性、良好的生物相容性、近红外区强烈的荧光发射、高性能的活性氧生成、良好的光热转换效率、优异的细胞吸收等多种特性和多种功能,并在肿瘤部位有效蓄积。体外和体内评价均表明,所述纳米成像系统是近红外荧光-光热双成像引导协同光动力-光热疗法的一个极好的候选方案。这项研究不仅扩展了AIE和黑磷材料的应用范围,而且为设计新一代癌症治疗方案提供了有益的见解。
1.复合纳米片的制备与性能
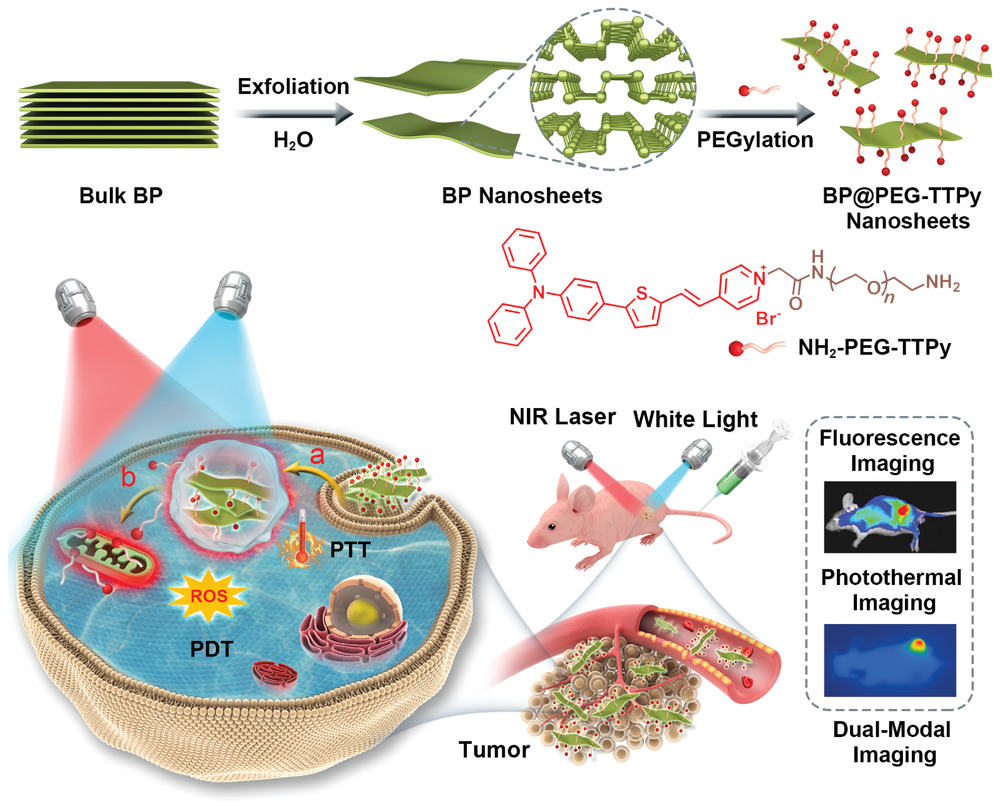
图1 BP@PEG-TTPy纳米片制备过程及其作为NIR FLI-PTI双成像引导协同PDT-PTT的应用示意图。
NH2-PEG-TTPy的结构如图1所示,由于具有正电荷的吡啶部分和聚乙二醇胺(PEG-NH2)片段,具有良好的水溶性。此外,其在固态下的荧光量子产率为10%,比水溶液(0.5%)高约20倍,显示出典型的AIE特性。然后将NH2-PEG-TTPy嵌入黑磷(BP)表面,直接生成所需的纳米材料BP@PEG-TTPy(图1),以及以PEG-NH2为原料制备了BP@PEG纳米片作为对照。
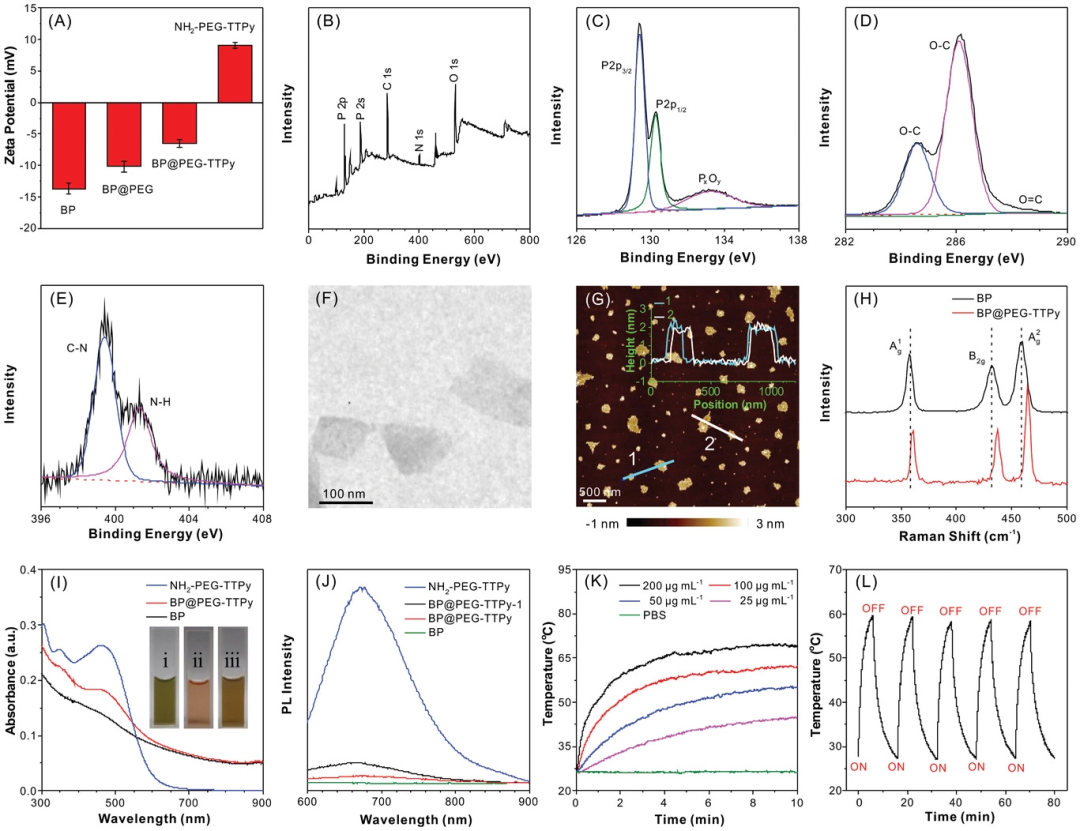
图2 A) 样品的Zeta电位。B–E)x射线光电子能谱BP@PEGTTPy:分别是测量、P2p、C1s和N1s光谱。BP@PEG-TTPy的F)TEM和G)AFM图像。H) 样品的拉曼光谱。I) 样品的紫外-可见-近红外光谱。J) 样品的荧光光谱。浓度:NH2‐PEG‐TTPy(4 mg mL−1),BP@PEG-TTPy‐1(50µg mL−1的BP NSs,4 mg mL−1的NH2‐PEG‐TTPy),BP@PEGTTPy(100µg mL−1 BP纳米片,4 mg mL−1 NH2‐PEG‐TTPy)和BP纳米片(100µg mL−1)。激发波长:488nm。K)在808nm近红外激光照射下,不同BP浓度的PBS中的BP@PEG-TTPy的光热加热曲线。L) 在PBS中BP@PEG-TTPy的光热稳定性,使用808 nm近红外激光,进行5次开/关辐照循环。
BP@PEG-TTPy的光学性质。在PBS中的BP@PEG-TTPy具有从紫外到近红外的吸收带。另外,其发射波段很宽,最大强度位于672nm处(图2J)。在PBS中的BP@PEG-TTPy在808nm近红外激光照射下显示了浓度和功率密度相关的温度变化行为。在较低BP@PEG-TTPy浓度(含100µg mL−1BP纳米片)下辐照10min,温度可显著达到61℃。光热转换效率(η)为28.9%。在用808nm近红外激光(1W cm−2)照射五个周期后,在循环过程中温度没有明显变化,显示出较高的光稳定性。
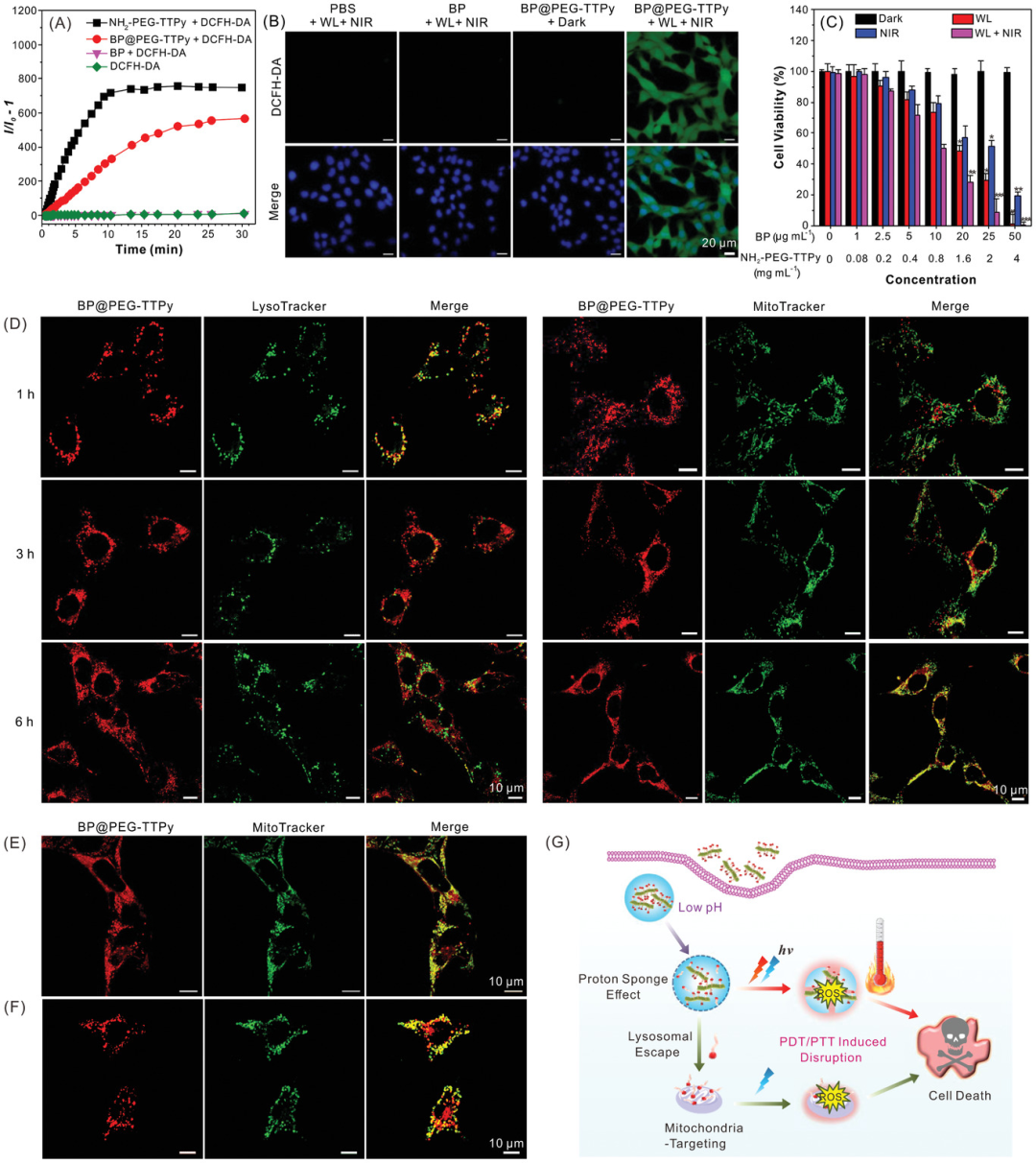
在808nm近红外激光(1W cm−2)和/或白光(WL)辐照下, NH2-PEG-TTPy和BP@PEG-TTPy(2mg mL-1)的活性氧生成在30分钟内分别达到753和575倍的增强(相对于纯BP纳米片),显示高效活性氧生成。这是因为NH2-PEG-TTPy的重原子效应和高的给受电子强度,赋予其更有效的系间窜越。
图3 A)以DCFH-DA为指示剂,在白光和808nm近红外激光照射下产生ROS。B) DCFH-DA检测4T1细胞内ROS的产生。核被Hoechst33342染色。C) 4T1细胞经BP@PEG处理后的相对存活率,在不同BP和NH2-PEG-TTPy浓度下,使用或不使用白光(WL,24 mW cm−2)和/或808 nm NIR激光(NIR,1 W cm−2)照射10 min.*P<0.05、**P<0.01和***P<0.001。D) 4T1细胞在于BP@PEG-TTPy、LysoTracker绿和MitoTracker绿分别以预先安排的时间间隔复合染色后的CLSM成像。E、 F)白光照射5min和808nm近红外激光照射前后线粒体形态学的变化BP@PEG-TTPy和MitoTracker绿色。G) BP@PEG-TTPy细胞内给药途径与协同抗肿瘤治疗。
2.实际应用
将BP@PEG-TTPy用于光热治疗(PTT)和光动力治疗(PDT)的联合应用。PTT和PDT联合治疗后IC50值(50%细胞死亡抑制浓度)分别测定为0.8 mg ml−1和10µg mL−1,远低于PDT或PTT单一治疗(图3C)。此外,BP@PEG-TTPy组合指数(CI)值为0.9。这些结果表明BP@PEG-TTPy通过PDT和PTT协同治疗,对癌细胞具有显著的消融作用。孵育4h后,大量NH2-PEG-TTPy积聚在线粒体中。在白光和808nm近红外激光同时照射5min后,线粒体由长管状变为小球状,证实了光介导的细胞凋亡导致4T1细胞的不健康状态(图3F)。同时,剩下的BP纳米片和NH2-PEG-TTPy作为光疗剂,用于热疗和ROS诱导的溶酶体细胞凋亡(图3G)。
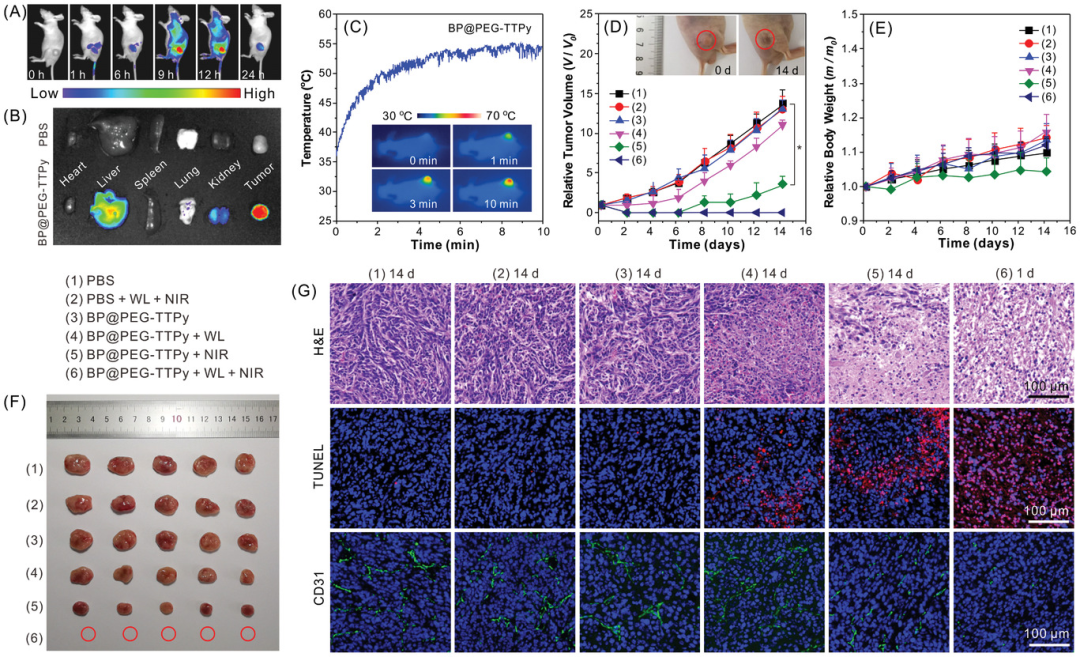
BP@PEG- TTPy在体内的应用。BP@PEG-TTPy在肿瘤组织中可以有效积累。在双光照射期间肿瘤部位的温度曲线在10分钟内显著升高并维持在54℃左右,这得益于BP@PEG-TTPy高效的肿瘤聚集和良好的光热性能。因此,在BP@PEG-TTPy可在肿瘤治疗过程中提供精确的指导。
图4 荷瘤小鼠体内显像及抗肿瘤作用。(A)注射BP@PEG‐TTPy后小鼠的延时NIR FLI。B) 注射BP@PEG24 h后主要器官和肿瘤的体外近红外荧光图像.C)在808 nm近红外激光(NIR)和白光(WL)照射下,注射BP@PEG‐TTPy的带有肿瘤的裸鼠肿瘤区域温度变化和相应的红外热成像。D、 E)每隔一天记录不同治疗后小鼠肿瘤体积(D)和裸鼠体重(E)的变化(*P<0.05)。(D)插图:第0天和第14天第(6)组小鼠的代表性照片。F) 在第14天,从所有组中处死的小鼠身上切除肿瘤的数码照片。G) 不同治疗组的肿瘤切片:H&E染色,有代表性的TUNEL染色图像(蓝色:DAPI和红色:TUNEL荧光素)和CD31染色图像(蓝色:DAPI和绿色:CD31-荧光素)。
BP@PEG-TTPy的抗肿瘤作用。第6组荷瘤小鼠为BP@PEG-TTPy+白光+808nm近红外激光治疗,表现出最佳的抑瘤效果。第二天肿瘤完全消融,治疗期间未见复发,与体外增强抗癌疗效一致。此外,所有组的体重都缓慢增加,并且在治疗过程中没有小鼠死亡(图4E),这证实了所有治疗都没有明显的副作用。
亮点小结
综上所述,作者首次成功地研制出了AIEgen与二维黑磷纳米片相结合。该杂化纳米材料具有高稳定性和良好的生物相容性,能够有效地产生活性氧,具有较强的FR/NIR荧光和良好的光热转换效率。这些显著的特点使其在体外和体内癌症治疗方面具有显著的性能,包括NIR FLI-PTI双成像引导协同PDT-PTT。这个成功的多模式治疗的例子将为下一代癌症治疗的高效治疗系统提供一个蓝图。
全文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202003382