免疫疗法在治疗晚期或转移性肿瘤患者方面具有巨大的前景,但仅针对免疫刺激性肿瘤患者。其中,肿瘤微环境(TME)是肿瘤细胞和肿瘤浸润淋巴细胞(TILs)相互作用的主要位置。因此,肿瘤对免疫疗法的反应性至少部分取决于TME免疫表型。
研究表明,激活STING(一种胞质衔接蛋白,响应内/外源性胞质核酸配体)信号通路会强烈刺激TME中的先天性和适应性免疫反应。此外,激活肿瘤细胞中STING途径可导致自然杀伤(NK)细胞渗透到肿瘤中,引发抗肿瘤反应。
然而,需要新颖的方法以最小的免疫副作用增强肿瘤对环状二核苷酸(CDN)的敏感性。众所周知,喜树碱(CPT)等化学治疗药物可通过刺激DNA损伤来触发细胞死亡。研究发现,部分小分子药物可能通过触发STING途径和激活免疫系统发挥其抗癌作用,为化学-免疫疗法提供了希望。
近日,美国约翰霍普金斯大学的Honggang Cui(通讯作者)团队报道了一种STING激动剂环状di-AMP可以在肿瘤内延长释放,将肿瘤微环境(TME)从免疫抑制转变为免疫刺激,从而增强抗肿瘤治疗的效果。在水溶液中,两亲性药物自组装成超分子纳米管(NTs)。
带负电荷的STING激动剂(c-di-AMP(CDA))通过静电络合在带正电荷的NTs表面上。在注射到肿瘤部位后,CDA-NT溶液立即形成水凝胶,充当CDA和CPT的延长局部释放的储存库,以唤醒先天和适应性免疫系统。
在小鼠肿瘤的多个模型中,单次低剂量的STING兴奋剂可导致肿瘤消退和提高动物的存活率,并出现长期免疫记忆和全身免疫监视,从而保护小鼠免于肿瘤的复发和转移。总之,这种局部递送的STING激动剂帮助减少肿瘤的免疫抑制,并增强对各种癌症治疗的效果。
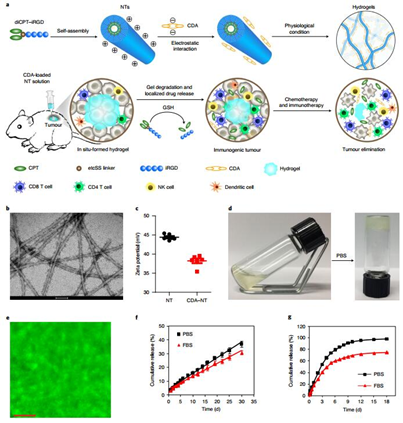
水凝胶的制备
作者通过二硫代乙基碳酸酯(etcSS)接头将两个CPT分子化学偶联至iRGD,从而形成两亲性分子(diCPT-iRGD),进而自组装成超分子NTs。在GSH作用下,CPT可以从diCPT-iRGD中有效的释放,并且在2 h内几乎100%的释放CPT。
在diCPT-iRGD水溶液中添加CDA后,Zeta电位的降低,表明带负电荷的CDA被吸附在NTs的表面上。增加CDA-NTs的浓度或添加抗衡离子,可形成CDA-NTs水凝胶。共聚焦成像显示,标记的CDA的FITC信号均匀分布在水凝胶的冰冻部分。diCPT-iRGD偶联物具有相对稳定的线性释放,在PBS中30 d内释放了37.2%药物,而纯CDA在PBS中18 d内就释放了98%。
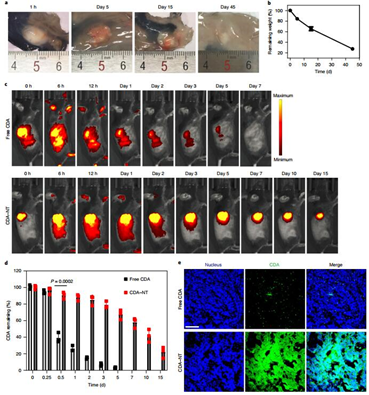
STING激动剂在体内局部保留和可持续释放
作者将diCPT-iRGDNT溶液皮下注射到C57BL/6小鼠背部,以评估其在体内的凝胶化和生物降解。在注射1 h后,出现球形水凝胶,但45 d内被逐渐的生物降解。该水凝胶显示出近乎线性的降解曲线,45 d内降解了约75%。注射5 d后,游离CDA处理的肿瘤的荧光强度迅速下降,几乎没有观察到荧光信号,而CDA-NT治疗组的荧光强度在注射15 d后仍然很强,35 d后仍可检测。需注意,STING激动剂在肿瘤组织中的特定沉积也可能减少脱靶毒性和免疫副作用。CDA-NT治疗组在整个肿瘤中均显示出强烈的荧光,证实diCPT-iRGD NT水凝胶可有效地递送药物。
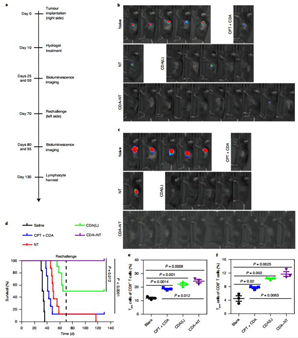
CDA-NT水凝胶对肿瘤的作用
作者利用皮下GL-261脑肿瘤模型评估了CDA-NT水凝胶的协同抗肿瘤作用。在接种10 d后,肿瘤体积约100-150 mm3,将CDA-NT溶液注入肿瘤中。利用diC8-iRGD作为无药物的水凝胶(E-Gel)用于CDA(CDA(L))局部递送。其中,仅用CDA(L)进行治疗不足以完全抑制肿瘤生长。使用diCPT-iRGD NT水凝胶时,CDA-NT治疗导致肿瘤消退,并且小鼠的存活率为100%。而单独化学疗法NT和免疫治疗CDA(L)仅有12.5%和50%的存活率。需注意,这些受试小鼠的体重不受局部治疗的影响。同时,CDA-NT局部递送不会对研究小鼠引起明显的全身性不良反应。

CDA-NT局部递送诱导的持久免疫反应
在第70 d时,所有组存活的小鼠都被重新注射,以确定在另一侧是否产生新的肿瘤。在接种肿瘤细胞第10 d后,在幼鼠中清楚观察到肿瘤的生长,并持续长成大肿瘤。对于CPT+CDA、CDA(L)和CDA-NT组中存活的小鼠,GL-261细胞的生物发光信号在第95天仍未检测到,表明这些存活小鼠的肿瘤生长被有效的抑制。需注意,CDA-NT处理的小鼠的总体生存率明显更高。在用STING激动剂治疗的小鼠中,CD8+CD44 highCD62L high central memory T(Tcm)细胞和CD8+ CD44highCD62Llow效应记忆T(Tem)细胞的百分比均增加。
经CDA-NT处理的小鼠表现出更高的CD8+Tcm(24.4%)和Tem(11.7%)细胞百分比。结果表明,CDA-NT的局部递送可诱导T细胞记忆并形成抵抗肿瘤复发的长期免疫力。
综上所述,作者开发了一种基于药物的超分子水凝胶系统,用于局部递送CDNs,从而增强对肿瘤的化学-免疫治疗效果。该水凝胶有助于将免疫治疗性CDA和化疗药物CPT递送至肿瘤部位,从而激活NK细胞、树突状细胞和T细胞,显着提高不同肿瘤模型下小鼠的整体存活率。此外,水凝胶的局部给药可引起长期免疫记忆和全身性免疫监视,抑制肿瘤的复发和转移。总之,这种局部给药的化学-免疫水凝胶增强了抗肿瘤免疫反应,并以安全有效的方式增强肿瘤对免疫疗法的敏感性。
全文链接:


