“工欲善其事,必先利其器”,分析表征技术和设备在现代科学研究中的作用及地位越来越重要。比如在生命科学研究领域,很重要的一个过程是对生
物大分子(如蛋白质)结构进行解析。最开始科学家使用X射线晶体学成像技术来解析蛋白质结构,但是鉴于蛋白质的松散构型,难以规律集群进行成晶。使用这种方法时,科学家们需要先对样品进行结晶——打包成稳定的、有序晶体,然后再允许X射线穿过样品进而成像
。这就造成了结构解析工作复杂程度大大增加,有时候解析一种蛋白质需要一个团队花费几个月甚至几年的时间才能完成。
【何为冷冻电镜?】
为了提高研究效率和精准度,科学家在电子显微镜的基础上于上世纪70年代开发出了可以直接“观察”蛋白质
结构的冷冻电镜(Cryo-EM)。相比于X射线技术,电子显微镜将经加速和聚集的电子束轰击到薄样上,使用感学器件来对散射后的电子成像,而因为电子的德布罗意波长非常短,使得这种显微技术的分辨率在理论上可以高达0.1 nm,因而这种可以用来观测物质精细结构。
而相对于传统电镜,冷冻电镜的制样环境是液氮浴中的液态乙烷罐中,这样样品会急速冷却以至于冰晶都来不及形成,而是形成一种叫做玻璃态晶的物质,因而可以很好地保持生物大分子地结构完整性。

冷冻电镜样品结构示意图
当电子束打到分子上之后就会在胶片上留下不同的印记,尽管这些
印记是二维图像,但是却包含了分子的三维信息。在随后的研究中,科学家们对这些图像进行平均化建模,而后产生了蛋白质的三维模型。
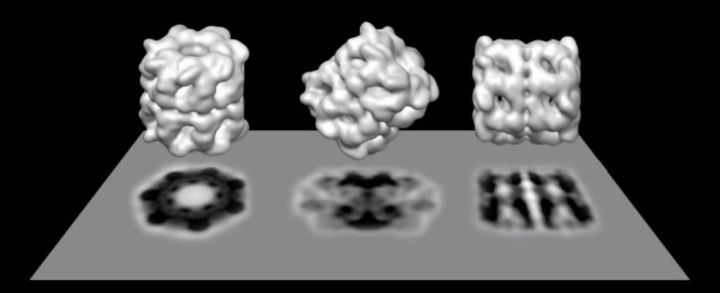
由于冷冻电镜的出现大大加快了生命科学以及临床医学等领域的发展,因此对冷冻电镜发明或改进具有里程碑意义的德裔生物物理学家Joachim
Frank、苏格兰分子生物学家和生物物理学家Richard Henderson和瑞士洛桑大学生物物理学荣誉教授Jacques Dubochet三人共同获得的了2017年诺贝尔化学奖(for developing cryo-electron microscopy for the high-resolution structure determination of
biomolecules in solution)。
【原子级分辨率新冷冻电镜】
尽管电子显微镜的理论分辨率可以达到1Å,但是目前冷冻电镜的分辨率为1.54~4Å,虽然这个分辨率已经
可以借助三维建模软件来建立蛋白质的原子模型(<4Å),但是还不能实现对真实原子位置直接可视化观测(对分辨率的要求为<1.5Å)。2020年5月22日,在bioRxiv预印版服务器上刊登了两篇关于冷冻电镜的最新研究进展的论文,研究内容均是对现有的冷冻电镜进行硬件(
电子源、能量过滤和相机)和软件优化,首次利用冷冻电镜看到蛋白质中的单个原子和化学键变化。这打破了冷冻电镜的观测壁垒,对于其实现原子级分辨率具有里程碑作用。
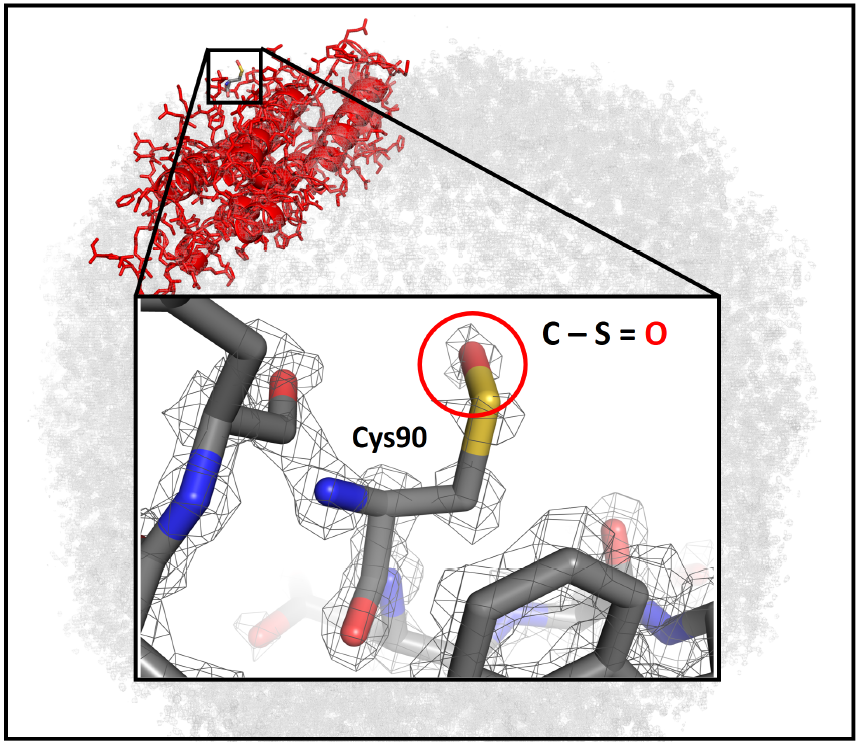
第一项研究由德国哥廷根马克斯·普朗克生物物理化学研究所的生物化学家和电子显微镜专家Holger Stark教授领导的团队完成,该研究以题为“Breaking the next Cryo-EM resolution barrier – Atomic resolution determination of proteins!”的论文
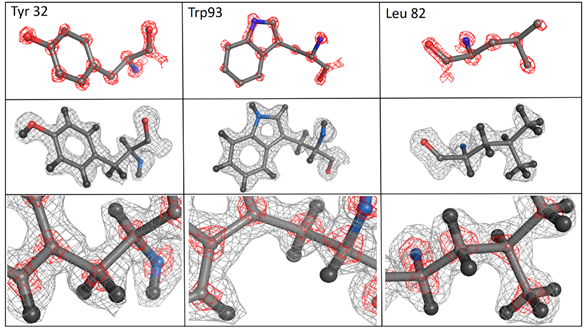
发表在bioRxiv上。在这项研究工作中,Holger Stark教授团队使用了一个带有附加电子光学元件(减少电子束的能量传播和通过像差校正器减少像差来改善了光学特性)的原型仪器来提高电镜的分辨性能,并对脱铁铁蛋白的原子结构进行了观察和建立。实验结果显示改进
后的冷冻电镜对脱铁铁蛋白的结构分辨率为1.25Å,并且第一次可以看到蛋白质中的单个原子、氢原子的密度和单原子化学修饰。同时,利用该冷冻电镜得到的脱铁铁蛋白结构的3D信息含量几乎是目前世界记录(1.54Å)的两倍。
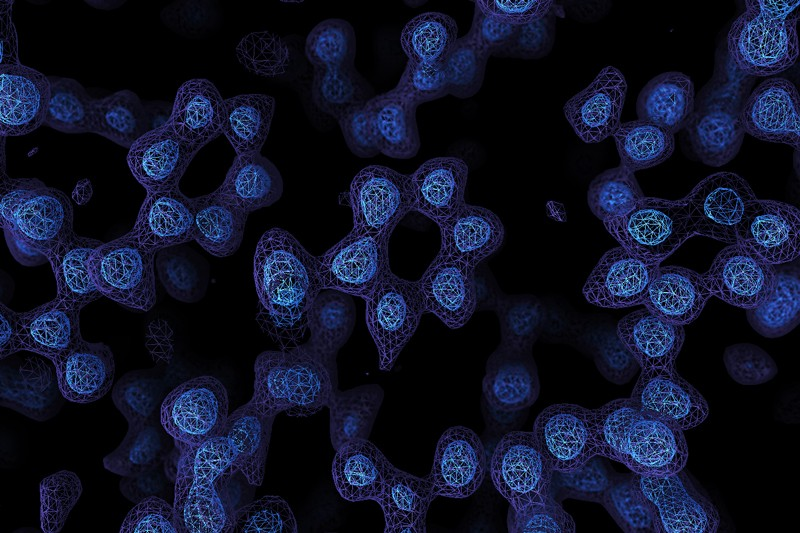
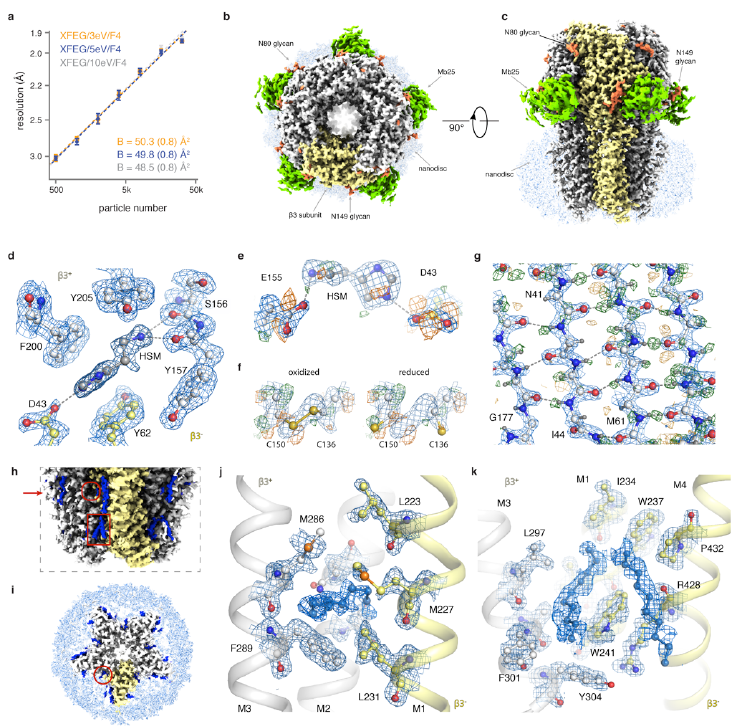
真正的原子分辨率:1.25 Å的分辨率显示单个原子和氢原子
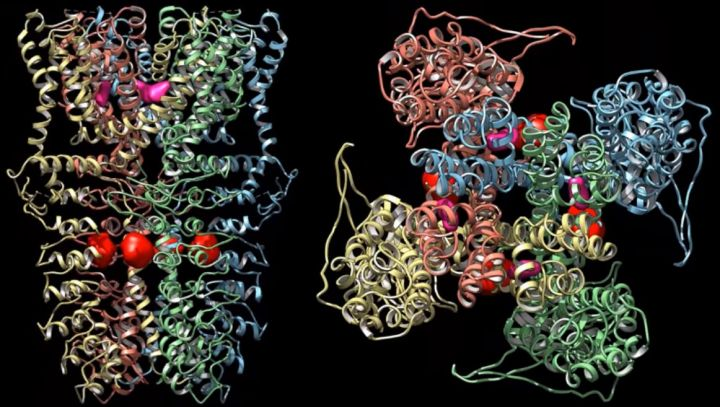
第二项研究由英国剑桥分子生物学医学研究委员会实验室(MRC-LMB)的结构生物学家A. Radu Aricescu和Sjors H.W. Scheres教授领导的研究团队完成,该研究以“Single-particle cryo-EM
at atomic resolution”的论文发表在bioRxiv上。在这项研究中,研究团队使用新的电子源、能量过滤器和相机对冷冻电镜进行改进,实现了人类膜蛋白(β3 GABAA受体)1.7Å的分辨率, 同时实现了老鼠脱铁铁蛋白1.2Å的分辨率,这一结果与Holger Stark教授团队研究
成果基本一致。这项研究提供了一个蛋白质分子的原子分辨率单粒子冷冻电镜。研究中得到的原子级精细图谱可以详细地理解小分子的配位,可视化溶剂分子和多种氨基酸的替代构象,以及明确地构建有序的酸性侧链和聚糖。此外,许多氢原子的散射势可以在不同的图
中显示出来,从而可以直接分析氢键网络。
原子分辨率冷冻电镜
重建的β3 GABAA受体结构
冷冻电镜进军能源领域
冷冻电镜最早是为方便生物大分子结构解析而研制出来的,它的主要优势在于在观察时可以保持物质在溶液状态中的形态结构完整性。因此,近年来许多科研人员借助冷冻电镜来研究无生物活性材料的结构
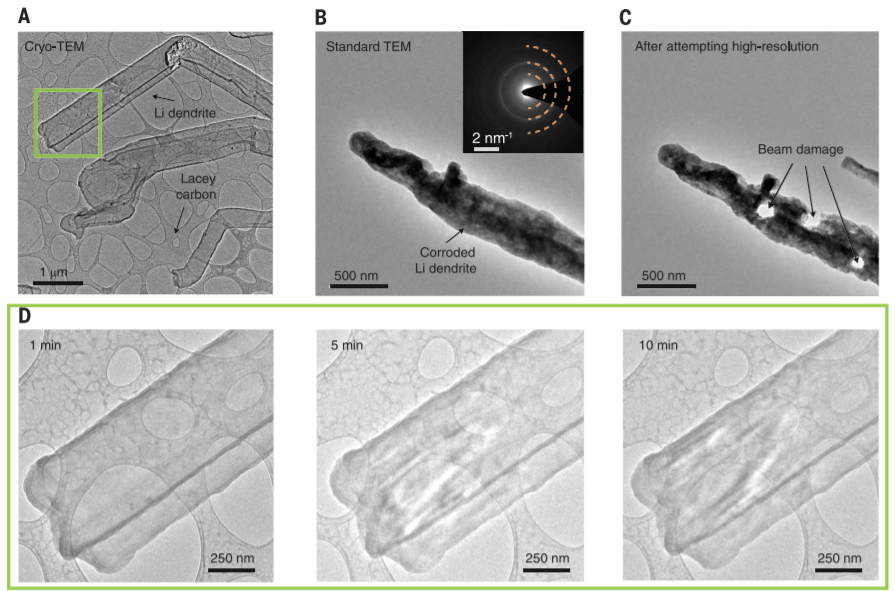
和演变。比如斯坦福大学崔屹教授联合诺贝尔物理学奖得主朱棣文教授在2017年利用冷冻电镜对锂金属枝晶进行了原子级别的观测,该研究成果发表在Science[Li et al., Science 358, 506–510 (2017)]上。
2015年,美国布鲁克海文国家实验室Oleg Gang教授研究团队利用冷冻电镜研究了DNA和Au颗粒自组装得到的八面体3D中尺度团簇。利用重构
技术将这种自组装结构清楚的展示出来,从而深入的研究了其自组装机理,对于精确控制3D中尺度自组装材料提供了基础。
冷冻电镜研究自组装
[Nature Nanotechnology, 2015, 10(7):637-644]
冷冻电镜进军高分子
2020年3月30日,日本信洲大学Daisuke Suzuki教授课题组采用低温电子层析成像技术(cryo-ET),首次得到了纳米复合微凝胶的详细结构信息。cryo-ET表明:在微凝胶内部形成的
SDS聚集体充当了聚苯乙烯的成核点位,阻止了PS颗粒的融合,解决了长久以来学术界对该问题的争论。
【总结与展望】
原子位置的直接显示对于理解蛋白质催化的化学反应机制以及研究药物结合和对蛋白质功能的干扰至关重要。剑桥大学和马克斯·普朗克
所研究小组经过对现有冷冻电镜的改造,首次观察到了蛋白质中的单个原子,这打破了现有冷冻电镜的观测壁垒,为蛋白质结构的解析工作以及其它物质结构的确定提供了更精准的分析手段。
参考文献:
(1)https://www.nature.com/articles/d41586-020-01658-1
(2) Yip, K. M., Fischer, N., Paknia, E., Chari, A. & Stark, H. Preprint at bioRxiv https://doi.org/10.1101/2020.05.21.106740 (2020).
(3) Nakane, T. et al. Preprint at
bioRxiv https://doi.org/10.1101/2020.05.22.110189 (2020).
(4) Li Y , Li Y , Pei A , et al. Atomic structure of sensitive battery materials and Interfaces revealed by cryo-electron microscopy[J]. Science, 2017, 358(6362):506-
510.
(5) Tian Y , Wang T , Liu W , et al. Prescribed nanoparticle cluster architectures and low-dimensional arrays built using octahedral DNA origami frames[J]. Nature Nanotechnology, 2015, 10(7):637-644.