虽然92年前抗生素的发现使得人类在细菌面前变得强大,但是因为越来越多的人滥用抗生素,导致耐药菌株不断出现,其中,耐甲氧西林金黄色葡萄球菌(MRSA)就是一大顽固的致病菌:例如心内膜炎、软组织和骨感染,为解决该问题,人们将目光放在人体最大的器官——皮肤上,因此,成功治疗MRSA感染的组织伤口仍然非常重要。最近的研究表明,无机杀菌剂在水凝胶中的传递可以驱动伤口愈合过程,然而,这种方法由于外部光刺激、细胞毒性、不可降解性和复杂的制造工艺而变得复杂。
对此,中国医学科学院生物医学工程研究所王伟伟团队、阜外医院潘湘斌主任医师和南开大学孔德领教授合作,利用两亲性的噁二唑基团修饰季铵盐(QAS)-共轭聚己内酯-聚乙二醇-聚己内酯(PCEC-QAS)胶束纳米抗菌剂的自发自聚集作用,制备了一种抗菌、可生物吸附的水凝胶。
该水凝胶适用温度广,在5~50℃呈稳定的凝胶状态,对革兰氏阴性菌和阳性菌均有体外和体内抗菌作用;此外,PCEC-QAS水凝胶可以促进细胞扩散、增殖和迁移,且无细胞毒性,在无药物、细胞因子下即可促进创面修复,无需后处理,PCEC-QAS水凝胶自身被完全吸收。该成果以“Synthetic Polymeric Antibacterial Hydrogel for Methicillin-Resistant Staphylococcus aureus-Infected Wound Healing: Nanoantimicrobial Self-Assembly, Drug and Cytokine-Free Strategy”为题于2020年9月18日发表在《ACS NANO》杂志
[PCEC-QAS纳米抗菌剂的自组装]
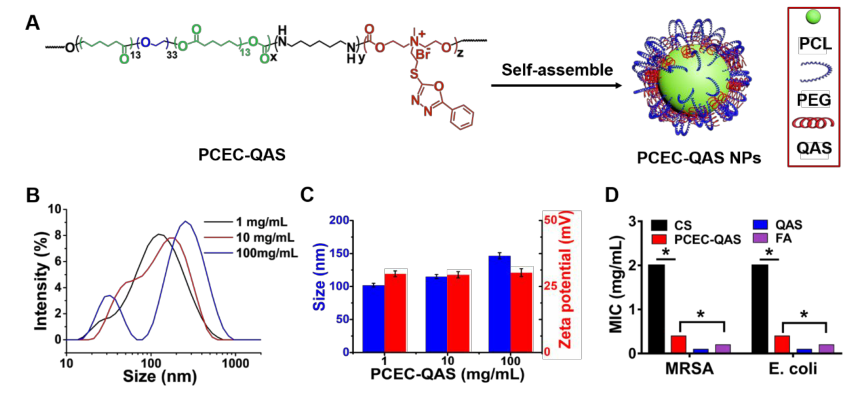
研究人员采用44-聚己内酯-聚乙二醇-聚己内酯(PCEC)促进抗菌水凝胶的转化。以PEG和辛酸亚锡为引发剂和催化剂,通过ε-CL开环共聚合成了PCEC三嵌段共聚物。如图1A所示,两亲性PCEC-QAS可在水中自组装成胶束纳米颗粒(NPs),其自组装主要由PCL嵌段间的疏水相互作用所驱动,形成疏水胶束核;水溶性PEG片段和QAS基团在水溶液中作为纳米颗粒外壳,并且随着QAS含量的增加,表面zeta电位逐渐增加。上述结果表明,PCEC-QAS可以组装成具有高度正表面电荷的纳米颗粒,有利于与细菌细胞膜进行亲和作用。
图1 PCEC-QAS纳米抗菌剂的自组装与表征
[PCEC-QAS纳米粒子自聚集形成不可逆水凝胶]
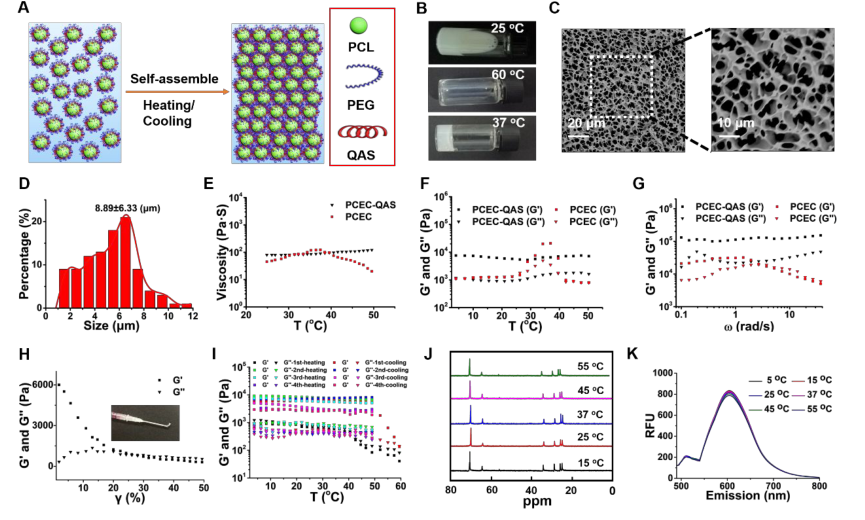
由于纳米颗粒的物理堆积(图2A),得到半固态水凝胶;图2C展示了PCEC-QAS水凝胶内的多孔网络结构,这种多孔结构可以模拟组织中细胞外基质(ECM)的三维结构,有利于细胞的分布、迁移、增殖和受损组织的重建;除此之外,PCEC-QAS纳米粒子形成的水凝胶具有不可逆性(图2B),该不可逆性源于PCEC-QAS胶束纳米粒子的稳定聚集;PCEC-QAS-NPs之间的非共价相互作用(端羟基间氢键的形成、QAS基团中苯环之间的π-π堆积以及静电相互作用)可以进一步增强不可逆性。因此,PCEC-QAS水凝胶便于实际应用,且凝胶对温度不敏感,可广泛应用于温度低至4℃的低温环境。
图2 PCEC-QAS水凝胶的形成与表征
[PCEC-QAS水凝胶体外抗菌活性与细胞毒性]
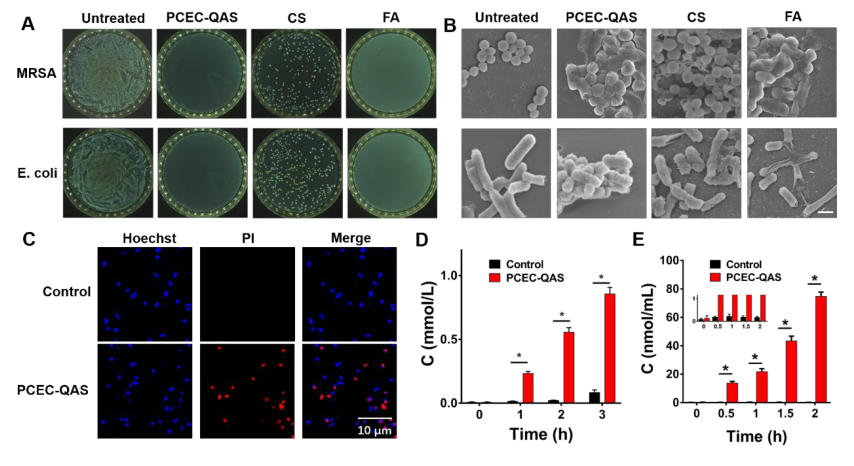
对PCEC-QAS水凝胶进行抗菌能力检测,图3A显示,PCEC-QAS水凝胶和FA乳膏(一种药物)组中未观察到菌落,而CS水凝胶组有菌落产生,因此,PCEC-QAS水凝胶对MRSA和大肠杆菌均具有抗菌作用;图3B显示处理后的细菌形态,未经任何处理的MRSA和大肠杆菌分别呈球形和棒状,细胞包膜光滑;而PCEC-QAS水凝胶或FA乳膏处理的细菌细胞膜和细胞壁均出现褶皱和扭曲,细胞严重受损。
图3 PCEC-QAS水凝胶的体外抗菌活性
[PCEC-QAS水凝胶组织相容性]
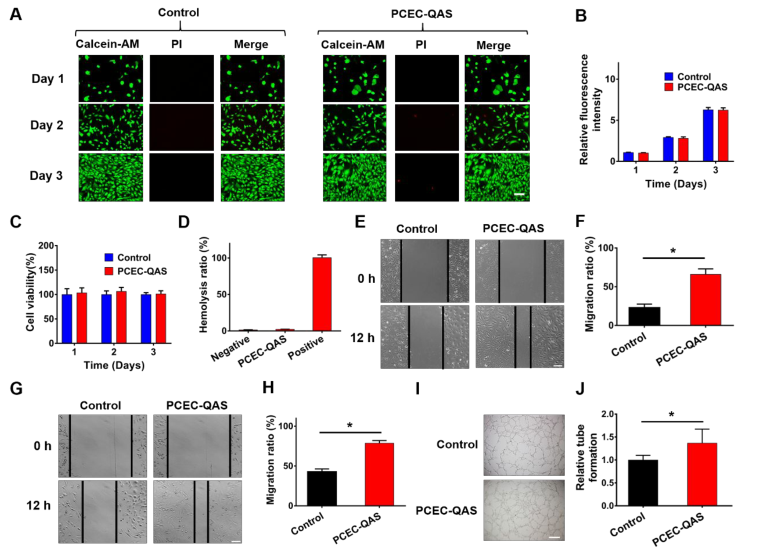
水凝胶和伤口组织直接接触,细胞相容性是关键。溶血试验(图4D)显示PCEC-QAS的溶血率为2.23±0.13%,PCEC-QAS水凝胶良好的血液相容性可能是由于PCEC-QAS中与QAS相连的官能团为5-苯基-1,3,4-恶二唑-乙基,而不是通常诱导细胞毒性和溶血的长烷基链,后者具有很强的插入细胞膜的能力。此外,水凝胶中的多孔微结构提供了一个三维的细胞外基质模拟环境,利于细胞生长。然后,研究人员评估内皮细胞和成纤维细胞在水凝胶上的迁移情况,图4E,G显示PCEC-QAS水凝胶改善了细胞的迁移,迁移率显著提高,可能是由于多孔结构为细胞分布提供了合适的环境以及有利于细胞粘附的阳离子特性所致。
图4 PCEC-QAS水凝胶的体外细胞相容性和溶血作用
[PCEC-QAS水凝胶的体内降解、全层皮肤缺损修复及抗菌性能研究]
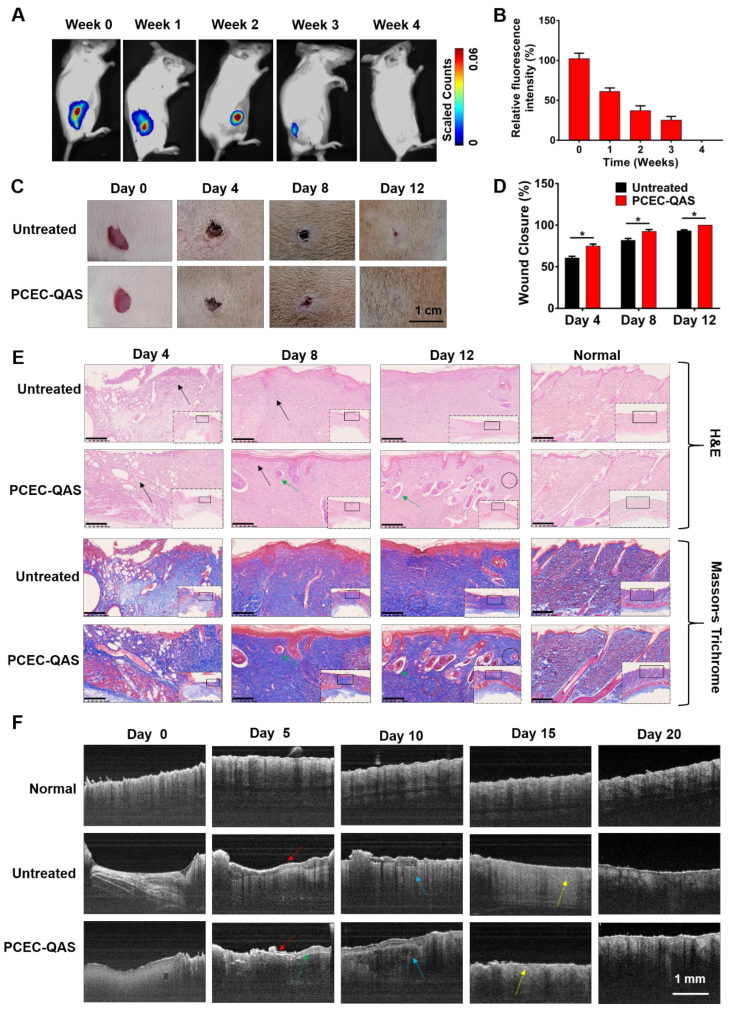
水凝胶敷料的降解对体内治疗有重要意义。如果不可降解成分在伤口修复后仍存在于体内,潜在的毒性和其他长期安全问题可能会限制抗菌水凝胶的应用;如果水凝胶能在体内完全降解,这些顾虑就可以消除,组织重建后不需要手术切除,有利于减轻患者的痛苦,降低医疗费用。图5A、B所示,皮下给药后,荧光信号衰减且强度降低,4周后完全消失,证明PECE-QAS水凝胶在体内没有引起明显的局部或全身毒性。
建立大鼠全层皮肤缺损模型,PCEC-QAS水凝胶组的伤口闭合率(图5D)在第4、8和12天分别为75%,90%和100%,表明8至12天,伤口几乎完全闭合,证明PCEC-QAS水凝胶可作为伤口愈合的有效敷料。利用光学相干断层扫描(OCT)进一步证明(图5F),水凝胶组皮肤表皮和真皮与正常皮肤基本相同,皮肤缺损已完全愈合。
图5 体内水凝胶降解与伤口愈合
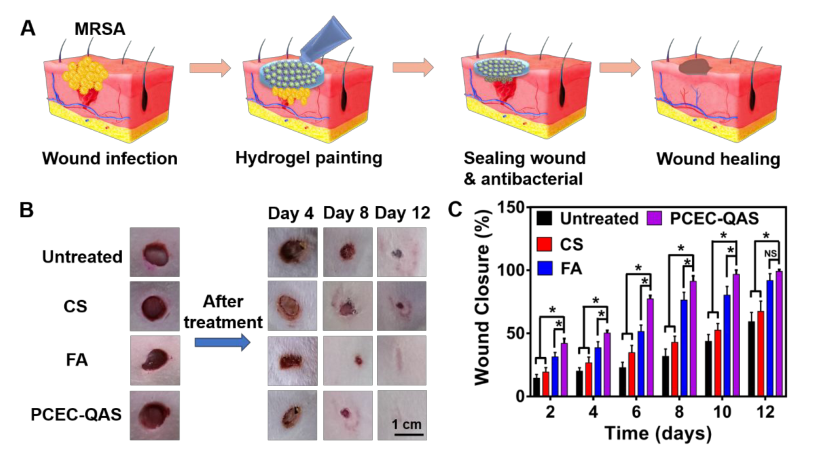
[PCEC-QAS抗菌水凝胶修复MRSA感染皮肤创面]
研究人员在被感染MRSA的大鼠背部进行实验,图6C显示,PCEC-QAS水凝胶组和FA霜组的伤口闭合率分别接近100%和92%,而CS水凝胶治疗组的伤口闭合率约为67%,12天后PCEC-QAS水凝胶组伤口完全恢复。
图6 PCEC-QAS水凝胶促进MRSA感染大鼠全层创面愈合
[结论]
研究人员通过PCEC-QAS纳米抗菌剂的自组装,设计了一种无毒、完全可生物吸附的抗菌水凝胶,与目前报道的抗菌水凝胶相比,PCEC-QAS水凝胶是通过物理聚集形成,简化了制备过程,有利于临床应用;且对温度不敏感,易于涂抹以完全封闭伤口;其生物可降解性和无毒性保证在使用安全;12天内加速MRSA感染皮肤伤口愈合也是其最大的亮点。
全文链接: