光热疗法(PTT)具有空间定向照射、微创和患者痛苦少的优势,有望应用于癌症和皮肤疾病的治疗。囊泡光热治疗剂(PTA)的中空结构可以将入射光进行多次反射而拥有卓越的光捕获能力及多功能性,受到广泛关注。到目前为止,用作PTA的囊泡多是由脂质体等小分子自组装而成,结构稳定性差。因此,开发结构稳定、光热转化效率高的囊泡型PTA非常具有挑战性。
聚合物囊泡具有结构稳定的特点,在PTT的应用中具有很大的潜力。但是聚合物囊泡的光热转化效率差,难以作为PTA应用。这是由于脂质体的膜流动性比聚合物囊泡高得多,因此脂质体的发色团可以形成结构完美的π-π堆积状态,而传统聚合物囊泡则很显得有心无力,因此光热转化效率较低。
成果介绍
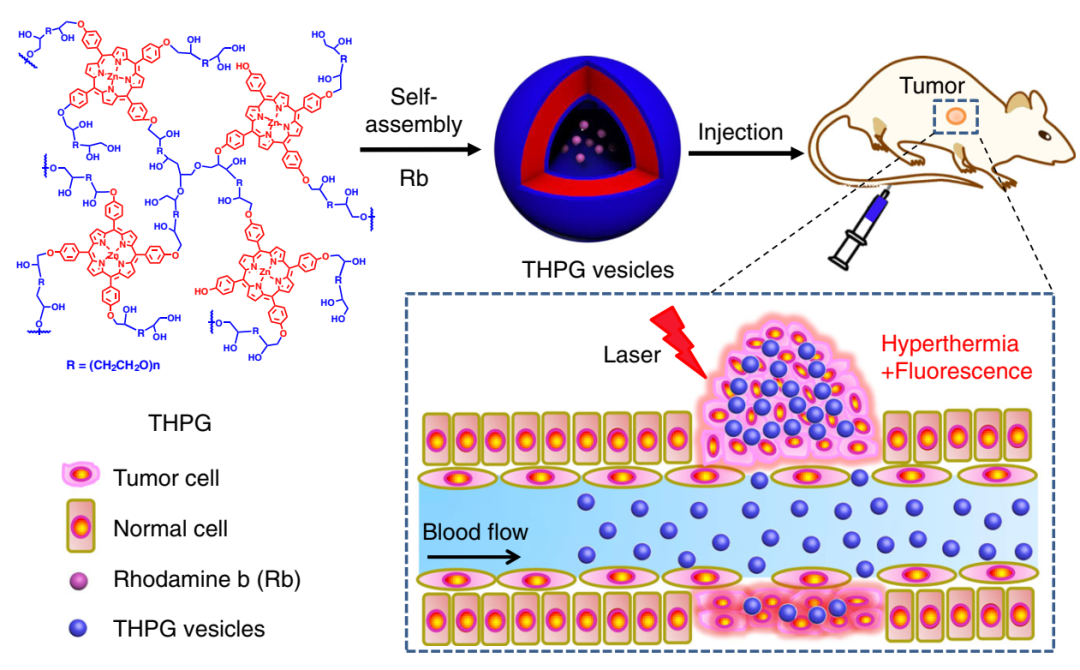
基于以上分析,上海交通大学周永丰教授课题组首次提出将共价聚合物自组装和超分子聚合相结合制备囊泡的设想,称之为“超分子聚合增强的自组装”(SPESA)过程,并基于超支化的卟啉自组装制备出了纳米聚合物囊泡(THPG)。发现这种囊泡具有坚固的膜结构和出色的膜流动性,膜内的卟啉单元通过定向π-π堆叠,可以形成结构完善的堆积状态。在极低的激光功率密度下(200 mW·cm-2),THPG囊泡的溶液温度从24.1℃可迅速升高至46.8℃,光热转化效率达到惊人的44.1%,而且具有优异的生物相容性。在对小鼠注射24小时后,THPG囊泡逐渐在肿瘤细胞内聚集,小鼠肿瘤在两天后形成了焦痂, 14天后自然脱落,而且没有复发,THPG囊泡对MCF-7肿瘤表现出具有优异的治疗效果。
囊泡自组装和结构表征

为了制备出囊泡结构,研究者以二环氧醚为A2单体,以四(4-羟苯基)卟啉锌(ZnTHPP)为B4单体,进行了阴离子聚合反应,制备出了两亲性超支化多卟啉聚合物(THPG),分子量为6.4 kDa,分子量分布为1.8。
SEM发现THPG的超分子聚集体为球形,平均直径127 nm,从动态光散射(DLS)获得的THPG流体动力学直径为176 nm。有些纳米颗粒破裂后显示出内部的空心腔,表明该颗粒为聚合物囊泡,平均壁厚为约21 nm。THPG在四氢呋喃中的UV-Vis吸收光谱显示出两个强吸收区,分别为B带(425 nm)和Q带(从545至626 nm)的卟啉。然而,THPG囊泡在水中的吸收峰明显加宽,B谱带红移至463 nm,Q谱带延伸至560至650 nm波长,这表明THPG囊泡中卟啉之间的π-π堆积形成了强J聚集体。
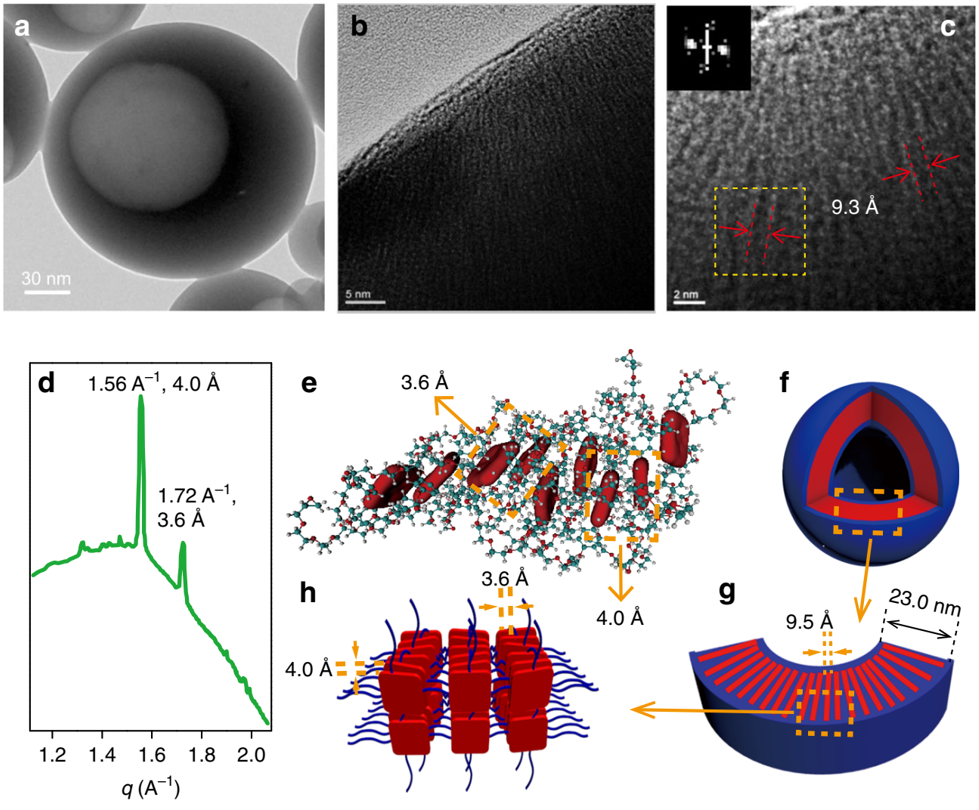
研究者详细研究了THPG囊泡膜中的分子排列方式,采用高分辨率TEM对破裂囊泡进行观察,发现疏水性卟啉单元通过π-π相互作用实现了超分子聚合,形成了黑色纳米丝,亲水性二环氧醚部分形成了白色条纹,黑色纳米丝的平均宽度约9.3Å。同步SAXS测量也在q = 1.72和1.56Å-1处发现了两个尖峰,这是相邻卟啉单元之间的π-π堆积形成的。
研究者通过分子动力学(MD)模拟,证实了囊泡的自组装机理,发现卟啉易于通过π-π堆积进行有序排列,并呈一定的螺旋角度,两个卟啉单元之间的分子间距离为3.6 Å,由于π-π堆积每个卟啉对的平均能量为29.7 kCal·mol-1。
经过一系列结构表征和模拟研究,研究者认为THPG在水中在疏水相互作用的驱动下自组装成膜厚度约为21 nm的囊泡。这种共价聚合物的自组装过程触发了分子内或分子间卟啉基团的紧密聚集,促使卟啉基团进行超分子聚合成平均宽度约为9.5Å的纳米丝,并在π-π堆积的驱动下形成了少量螺旋J聚集体。本研究首次报道了通过共价和非共价聚合物自组装过程,诱导形成了独特的囊泡结构。
囊泡的光热效率和稳定性分析
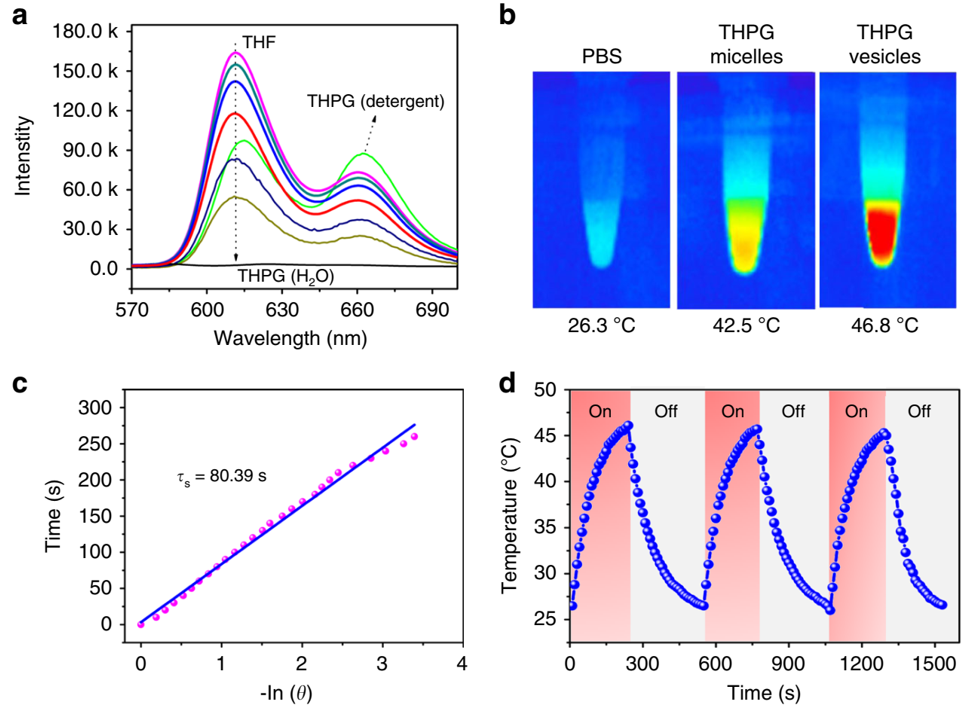
THPG聚合物在THF中显示出很强的荧光效应,但是在加入水后这一效应逐渐衰减,在纯水中则完全淬灭。这是由于向THPG/THF溶液中加水后,触发了THPG囊泡的自组装过程。结果,由于π-π堆积相互作用导致了卟啉的超分子聚合,在囊泡内形成纳米丝,从而造成荧光自猝灭。但是向THPG囊泡中添加5%Triton X-100清洁剂后,荧光恢复,这是由于π-π结构被破坏,囊泡分解造成的。
为了研究THPG囊泡的光热性能,研究者通过红外热成像仪记录了635nm激光照射后囊泡水溶液的温度变化。发现即使在非常低的激光功率密度下(200 mW·cm-2),THPG囊泡溶液的温度仍从24.1℃迅速升高至46.8℃,而PBS溶液的温度仅升高了2.1℃,这说明THPG囊泡具有优秀的光捕获并转化为热量的性能,经计算发现THPG囊泡的光热转化效率高达44.1%,远高于大多数有机光热剂。经过635 nm激光的三个加热和冷却循环后,THPG囊泡的平衡温度依然保持在46.1℃左右,表现出优异的光热稳定性,这与囊泡内卟啉之间的强π-π堆积相互作用、多层膜结构以及疏水单元之间的疏水作用密不可分。
囊泡光热治疗剂的体外细胞评估
研究者通过甲基噻唑基四唑鎓(MTT)对NIH/3T3小鼠胚胎成纤维细胞的影响,评估了THPG囊泡在体外的潜在细胞毒性。发现即使在浓度高达0.2 mg·mL-1的THPG囊泡中孵育48 h后,3T3细胞的相对活力仍保持在86.0%,说明THPG囊泡对NIH/3T3无毒且生物相容性极好。
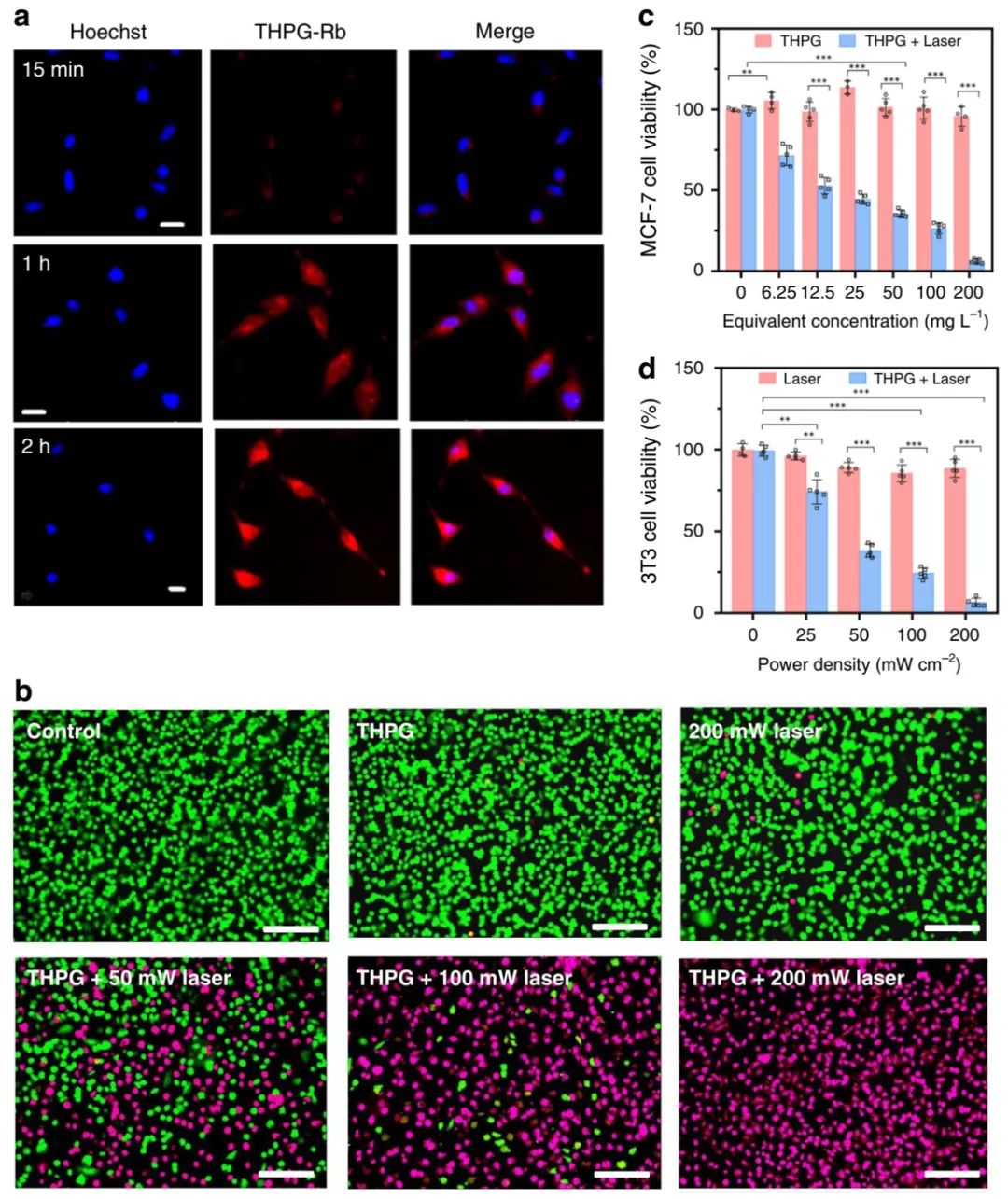
为了研究癌细胞对THPG囊泡的内化作用,研究者将MCF-7癌细胞与负载Rb的THPG囊泡在37℃下孵育,然后利用共聚焦激光扫描显微镜(CLSM)进行观察,发现随着孵育时间从15分钟增加到2 h,在癌细胞中观察到THPG-Rb发出的红色荧光持续增加,表明THPG-Rb囊泡被MCF-7细胞有效的摄取,在激光照射下,MCF-7细胞对THPG囊泡的摄取大大增强。
研究者进行了钙黄绿素-AM /碘化丙啶(PI)双重染色MCF-7细胞实验,直接的观察了体外THPG囊泡的PTT性能。发现摄取THPG后,MCF-7细胞非常健康。但是,以200 mg·mL-1的浓度与THPG囊泡孵育并用激光照射10分钟后的MCF-7细胞,随着激光功率的增加,死细胞的数量显著增加。
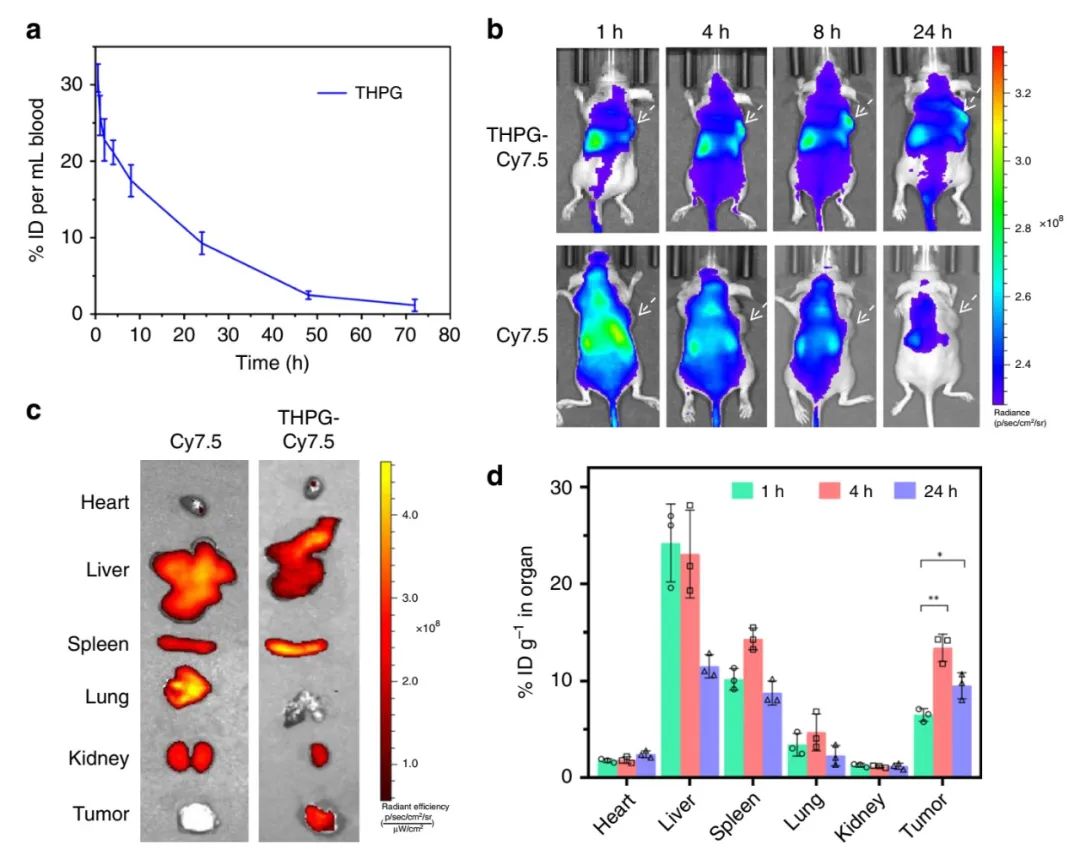
为了研究THPG囊泡在血液中的保留能力,研究者进行了药代动力学研究。发现THPG囊泡的血液循环半衰期为29.5 h,具有较长的血液循环能力,这是由于囊泡良好结构稳定性造成的。注射后72小时后,血液中THPG的浓度很低,表明THPG囊泡可以从大鼠体内清除掉。
研究者向具有MCF-7肿瘤的小鼠静脉注射THPG-Cy7.5囊泡(用Cy7.5的近红外染料包裹的THPG囊泡),进行了动物荧光成像实验。发现注射24小时后,体内游离Cy7.5的荧光信号弱于THPG-Cy7.5囊泡,这表明THPG-Cy7.5囊泡在体内的保留时间更长。在注射后24小时后,Cy7.5不会在肿瘤组织中积累,相比之下,THPG-Cy7.5囊泡的荧光信号在肿瘤位置处在24小时后仍然很明显。
研究者进一步研究了肿瘤和其他主要器官中THPG的累积。发现注射24小时后,在小鼠大多数器官中THPG含量显著下降,但是肿瘤中的含量下降不明显,表明THPG囊泡在24小时后逐渐聚集到肿瘤组织上。
囊泡光热治疗剂的体内动物评估
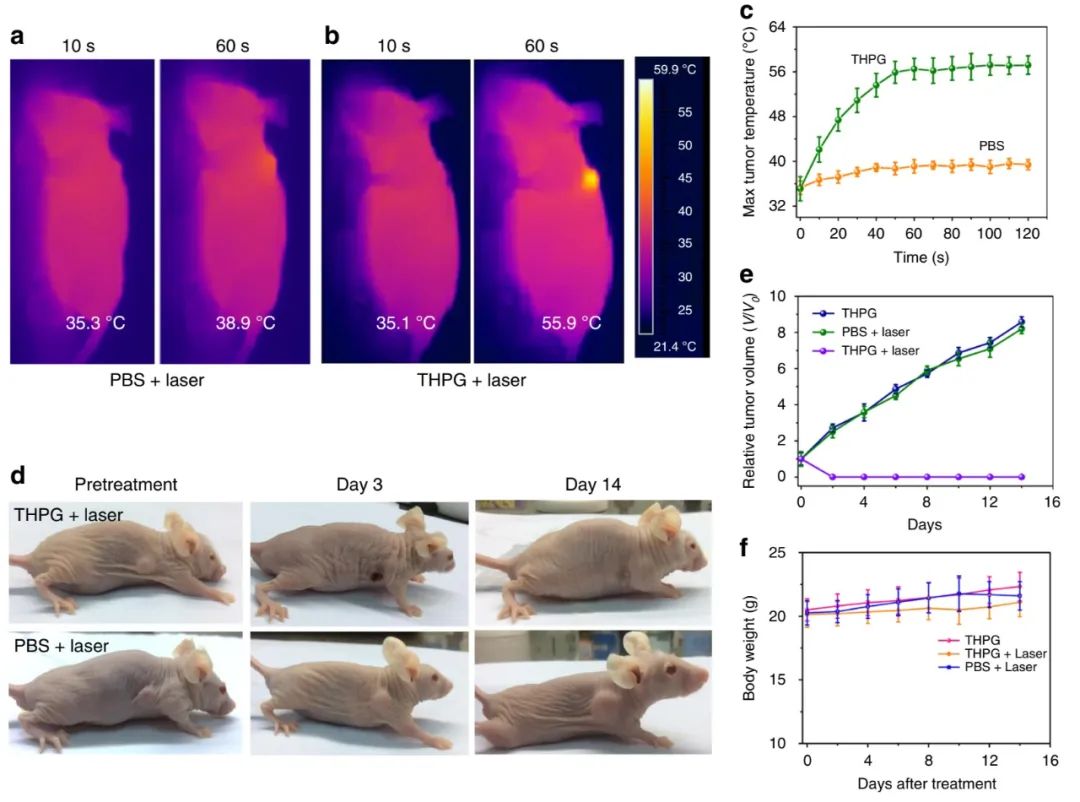
研究者进一步研究了THPG囊泡在体内的PTT功效。发现在注射THPG囊泡后,激光照射60秒后,小鼠肿瘤的温度从35.1℃升高到55.9℃,而对照组的小鼠肿瘤温度仅从35.3℃略微升高到38.9℃,这说明THPG囊泡光热传递效率非常高。
研究者将THPG囊泡注入小鼠体内4小时后,对肿瘤进行激光照射10分钟,研究了肿瘤的演变情况。发现注射PBS的小鼠肿瘤持续增加,注射THPG的小鼠肿瘤在两天后形成了焦痂,它在14天后自然脱落,而且没有复发。
小结
为了制备出结构稳定的PPT光热治疗剂,上海交通大学周永丰教授课题组基于“超分子聚合增强的自组装”过程,构建用于高效光热疗法的超支化多卟啉囊泡。发现制备的聚合物囊泡平均直径为176 nm,具有出色的生物相容性、结构稳定性和膜流动性。在π-π堆积相互作用的驱动下,囊泡中的卟啉单元可以进一步自组装成纳米丝状超分子聚合物,荧光自猝灭率高达1100,光热转化效率达到惊人的44.1%,在极低的激光功率密度下(200 mW·cm-2),THPG囊泡的溶液温度从24.1℃可迅速升高至46.8℃。在注射THPG囊泡并激光照射60秒后,小鼠肿瘤的温度从35.1℃升高到55.9℃,肿瘤在两天后形成了焦痂,14天后自然脱落,没有复发,所制备的聚合物囊泡对小鼠MCF-7肿瘤细胞显示出优异的治疗功效。