光疗诊断学近年来引起了人们的极大兴趣,因为它允许在光照开始时进行实时诊断和同时进行原位治疗,从而为癌症研究开辟了一条新的途径。目前人们不断探索各种诊断成像和治疗模式,以构建光疗系统。在各种诊断技术中,荧光成像(FLI)具有灵敏度高、响应快、无创性等显著优点,可在现场和时间上直观显示,但由于穿透深度不足,其在体内的应用受到严重限制。相比之下,光声成像(PAI)作为另一种光触发诊断方案,能够提供具有非常高成像深度的图像,并以微观空间分辨率描绘深部肿瘤轮廓,但缺乏灵敏度。
FLI与PAI的整合将明确有助于通过协调成像灵敏度、空间分辨率和穿透深度来获得丰富而精确的肿瘤信息。光疗法包括光动力疗法(PDT)和光热疗法(PTT),是一种光可控、无创、有效的治疗手段,PTT过程中产生的热信号也可以通过光热成像系统(PTI)捕获,从而提供良好的温度敏感性和实时监控的可能性。但是,由于PDT肿瘤微环境的缺氧性和PTT的热休克效应,PDT或PTT单独使用的效率通常是不令人满意的。
PDT和PTT的合作被认为是突破性的策略,可以克服各自的缺点,实现协同效应,提高治疗效果。例如,PTT可通过提高血流量改善肿瘤组织的供氧,从而促进PDT效应,从而进一步消除PTT中的耐热肿瘤细胞。因此,巧妙地构建多功能光疗系统,允许同时进行多模式成像和协同光疗将是至关重要的。
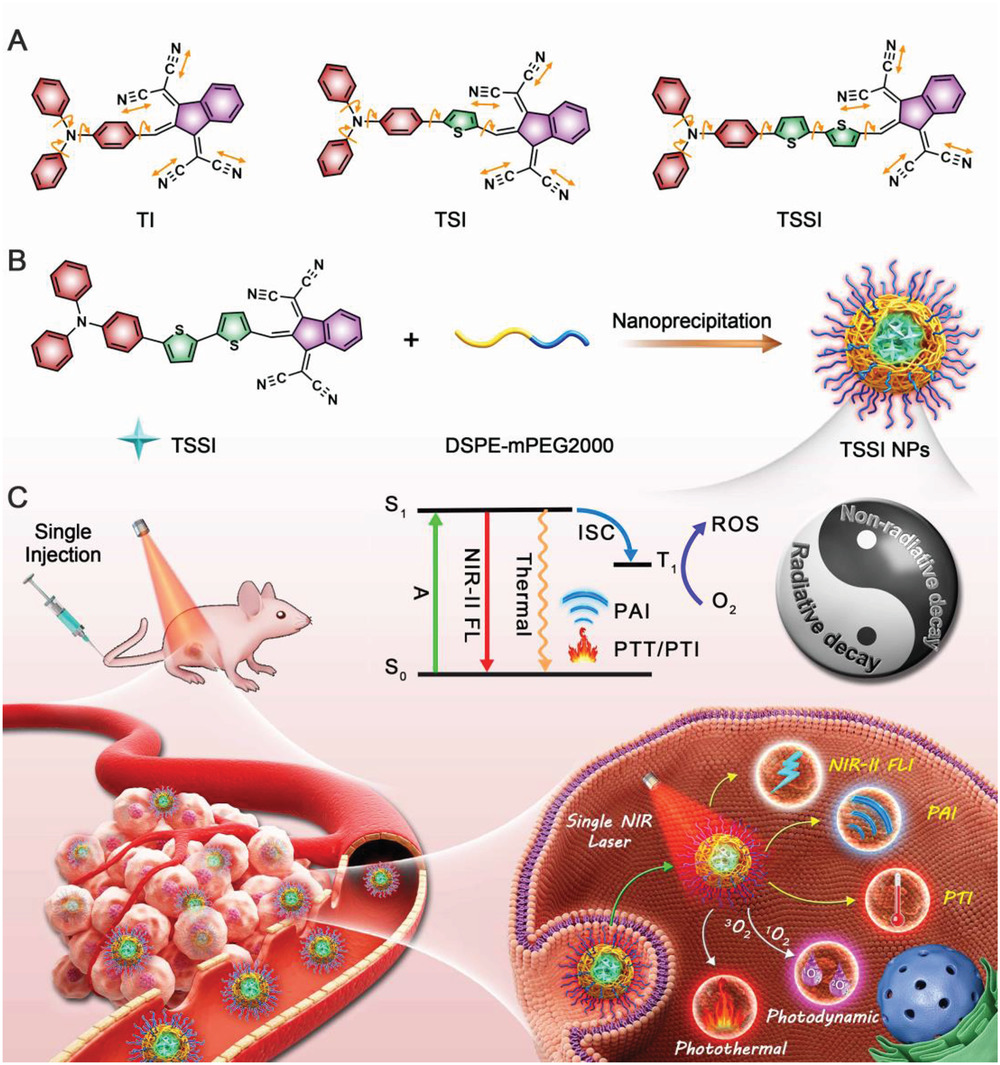
最近,唐本忠院士和深圳大学王东副教授在《Advanced Materials》发表了题为“An All‐Round Athlete on the Track of Phototheranostics: Subtly Regulating the Balance between Radiative and Nonradiative Decays for Multimodal Imaging‐Guided Synergistic Therapy”的通讯,报道了了一种简单而强大的基于聚集诱导发射(AIE)活性荧光团的光疗法。由于其强大的电子供体-受体相互作用和精细调制分子内运动, 基于AIE荧光团的纳米颗粒同时显示出明亮的近红外II(NIR–II)荧光发射、有效的活性氧生成以及在近红外辐射下的高光热转换效率,表明辐射和非辐射能量耗散之间实现了平衡。
此外,NIR-II FLI-PAI-PTI三模成像引导下PDT-PTT协同治疗的空前表现被精确的肿瘤诊断和完全的肿瘤清除结果所证明。因此,这项研究带来了一个新的见解,以发展优越的多功能光疗法用于癌症治疗。
1. 分子设计与性能
通常由于电子带隙的减小和系间窜越(ISC)过程的加强,电子供体-受体(D–A)相互作用整合到共轭结构生色团中可以显著促进红移吸收/发射和ROS生成。
在因此,他们设计了化合物TI、TSI和TSSI,由1,3-双(双氰甲基)吲哚部分(作为受体)、三苯胺(TPA)单元(供体D)和/或噻吩段(D和π桥)组成,显示出极强的D-A相互作用和不同程度的π-共轭。选择TPA部分是因为它不仅可以作为强电子供体,而且可以作为分子转子。
此外,TPA段高度扭曲的构象会延长分子间的距离,即使在聚集态也会导致相对松散的分子间堆积,这有助于保留部分分子内旋转,从而有利于纳米粒子内部的发热。此外,这些化合物的螺旋桨状扭曲结构还可以通过显著减少分子间π–π堆积而有效地抑制粒子内聚集体中的荧光猝灭。
另一方面,与分子内旋转相比,作为另一种高频分子运动的分子内伸缩振动对外界环境约束的敏感性较低,对提高产热极为有利。因此选择了两个丙二腈改性二氢化茚作为电子受体,不仅因为它的电子极度缺乏,而且主要考虑到结构中碳氮键的剧烈拉伸振动,并且这无疑有利于聚集态分子内的运动,很有希望作为分子内旋转的有力补充,以保证纳米粒子内PTT-PTI-PAI的良好效率。此外,TSI和TSSI的共轭主链中的噻吩段被设计成进一步增强供电子的性质,从而显著地使吸收/发射波长红移。
此外,在TI、TSI和TSSI中逐渐增强的D–A强度也可以显著提高具有细胞毒性的ROS的产生能力,从而提高PDT的效率。同时,噻吩环的引入也有望扩大TPA单元与大分子电子受体之间的分子内距离,进一步提高聚集态分子内旋转和光热转化效率。因此,具有最大D–A强度和聚集态分子内运动的TSSI化合物将是构建具有NIR–II发射的多功能光疗法的最有希望的候选材料。
图1 分子结构、纳米制造和多功能光疗应用的示意图。A)化合物的分子结构,包括TI,TSI和TSSI。B) 纳米沉淀法制备TSSI纳米粒子。C) 说明协调的光物理过程和TSSI NP在NIR-II FLI-PAI-PTI三模成像引导下的PDT-PTT协同癌症治疗中的应用。
TI、TSI和TSSI的光学性质。得益于从TI到TSSI的D–A强度的有序增强,这些化合物在固态中逐渐显示出620至664 nm的深红色最大吸收峰。这三种化合物在纯CHCl3溶液中都有微弱的发射,发射强度随着混合溶剂中正己烷含量的增加而逐渐增大,表明了它们典型的AIE特性。研究了其在DMSO溶液中的光热转化行为,在660nm激光照射5min后,TI、TSI和TSSI的温度迅速有效地升高,分别在47、54和61°C下达到稳定,证明由于溶液中分子的振动运动,激子能量主要通过热失活途径耗散。
图2 TI,TSI,TSSI和相应纳米粒子的光物理、光动力和光热特性。A) 固态归一化吸收光谱。B) 相对发射强度(I/I 0)与己烷分数的关系图。I 0和I分别是CHCl3和CHCl3/正己烷混合物中荧光强度的峰值。C) 660nm激光辐照下AIEgens(100×10−6M)在DMSO溶液中的光热转化行为比较。D) 纳米粒子的尺寸分布和E)TEM图像。F) 这些纳米粒子在水溶液中的归一化吸收光谱和G)归一化发射光谱。H) 在660nm激光照射下,这些纳米粒子(1×10−6M AIEgen)的ROS生成。I)比较这些纳米粒子(100×10−6 M AIEgen)在660 nm激光照射下水溶液中的光热转换行为。
为了制备生物相容性和分散性良好的AIE纳米粒子,疏水性TI、TSI和TSSI通过纳米沉淀法直接用两亲性共聚物DSPE-mPEG2000封装。纳米粒子表现出广泛而强烈的吸收,尤其是TSSI 纳米粒子的吸收几乎覆盖了整个NIR-I范围,尾部延伸至1000 nm。近红外区的长吸收波长是光疗诊断学在体内应用的重要前提之一,因为与紫外或可见光相比,它能深入组织,对组织造成的损伤更小。
研究了AIE纳米粒子的ROS生成效率。在TSSI纳米粒子存在下,经5min激光照射后,指示剂DCFH的发射强度达到250倍以上,TSSI纳米粒子的ROS产生效率明显优于TI和TSI纳米粒子,这可能是由于TSSI的D-A相互作用较强。评估了TI、TSI和TSSI 纳米粒子的光热效应。它们的溶液温度在近红外激光照射100秒内迅速升高,TSSI纳米粒子的温度升幅(ΔT≈28°C)高于TI纳米粒子(ΔT≈18°C)和TSI纳米粒子(ΔT≈24°C)。TSSI纳米粒子的光热转换效率约为46.0%,高于之前报告的绝大多数光热剂。
2. 光疗应用
TSSI纳米粒子对小鼠乳腺癌4T1细胞的体外协同光疗效果。TSSI NP在孵育3小时内大量内化到4T1细胞,并被捕获到溶酶体中。研究了近红外激光诱导的TSSI纳米粒子对4T1肿瘤细胞的杀伤作用。首先,在黑暗条件下,即使在高浓度下,TSSI NP也未发现对4T1肿瘤细胞和正常细胞(LO2和NIH 3T3)的明显毒性,表明其具有非凡的生物相容性。在NIR照射(660 nm,0.3 W cm−2,5 min)后,TSSI NP对4T1细胞具有超高的抑瘤效果,IC50(导致50%生长抑制的浓度)值低至7.3µg mL−1。这是因为活细胞可以有效地产生ROS,有效促进TSSI NP对4T1细胞的高光毒性。
图3 TSSI-纳米粒子对4T1肿瘤细胞株的细胞内吞及协同抑瘤作用。A) 用TSSI NP(10µg mL−1 TSSI)孵育3 h后的4T1细胞的CLSM图像。B)用TSSI NP和TSSI NP孵育24 h后的4T1细胞的细胞活力通过CCK‐8测定(平均值±SD,n=6)。C) 用PBS、PBS(+L,12h后)、TSSI NP和TSSI NP处理13 h(50µg mL−1 TSSI)的4T1细胞的细胞内ROS水平(上排)和活/死细胞染色(下排)。
TSSI纳米粒子的三模(NIR‐II FLI‐PAI‐PTI)成像能力。小鼠在给药TSSI纳米粒子(0小时)前用1020nm的长程(LP)滤光片显示出极微弱的自体荧光。在注射后6h,肿瘤区域出现强烈的NIR-II荧光信号,表明在EPR效应的驱动下,TSSI-NPs在肿瘤组织中显著积聚。研究了体内产生光声(PA)信号的能力。注射前(0h)检测到微弱的PA信号,随着时间的推移,肿瘤部位的PA强度明显增强,在注射后12小时达到稳定。因此PAI可以作为NIR-II-FLI的有力补充成像方式。然后在静脉注射TSSI纳米粒子12 h后,用660nm激光对荷瘤小鼠进行体内光热实验,用红外热像仪实时监测过程温度。2分钟内近红外辐射后肿瘤组织的温度可以上升至50℃左右,这表明PTT应用的巨大潜力。
图4 通过全身给药,体内多模式成像引导TSSI纳米粒子对4T1荷瘤BALB/c裸鼠的协同治疗效果。A) 给药TSSI NP后不同监测时间肿瘤组织的NIR-II FL图像(上排)和PA图像(下排)。B) TSSI纳米粒子注射后12小时连续近红外辐射期间肿瘤小鼠的热图像、加热温度(在肿瘤部位)。C) 不同治疗方法的荷瘤小鼠肿瘤生长曲线的时间依赖性(n=6,*p<0.001)。D) 不同治疗后第15天采集的肿瘤照片。E) 肿瘤组织H&E、TUNEL、CD31染色分析及不同治疗后肺组织H&E染色分析。TUNEL和CD31阳性细胞分别被染成红色和绿色。
评估TSSI纳米粒子的体内杀瘤活性。对4T1移植瘤BALB/c裸鼠全身给药,在此期间只进行一次注射,然后在注射后12小时仅进行一次NIR照射。在治疗后的第3天,几乎所有用TSSI纳米粒子加NIR照射的小鼠实体瘤都被消除了。随后,通过组织学和免疫组化研究进一步分析体内治疗机制。近红外激光诱导的协同热疗和基于TSSI纳米粒子的ROS可导致肿瘤组织广泛破坏,肿瘤细胞出现明显异常,空洞多,核固缩明显。
TSSI纳米粒的潜在全身毒性。在治疗过程中,每三天测量一次所有治疗小鼠的体重,未发现各组的体重有明显变化。15天后处死小鼠,采集血液进行血液学和血液生化分析。与生理盐水组相比,肝功能指标和肾功能指标的血液生化参数均较生理盐水组高,TSSI 纳米粒子给药组的尿素氮(BUN)似乎正常,差异无统计学意义,表明TSSI 纳米粒子没有明显的全身副作用。
图5 TSSI纳米粒子体内生物安全性评价。A) 不同处理组小鼠超过15d体重变化,C)给药后15天小鼠血液生化指标,包括肝功能指标(B)和肾功能指标(C)。D) 不同处理15d后主要器官的H&E染色切片图像。
亮点小结
综上所述,作者报告了一种基于单一AIE荧光团的全方位光疗剂,可同时实现FLI、PAI、PTI、PDT和PTT。得益于AIE分子丰富的分子内旋转体和振子、扭曲构象和高D-A强度,基于AIE分子的纳米粒子可巧妙地实现辐射和非辐射激发态能量耗散之间的平衡,在单次660nm激光照射下表现出显著的NIR-II荧光信号、极高的ROS产生和46%的光热转换效率。体外和体内实验均表明,具有良好生物相容性的AIE 纳米粒子在NIR‐II FLI‐PAI‐PTI三模成像引导下的PDT–PTT协同治疗中表现良好,只需一次注射和一次照射即可同时精确地成像肿瘤并完全消除肿瘤。与传统的all-in-one策略相比,基于AIEgen的one-for-all策略在实现多模式功能和最大化光疗效果方面更为直接。
全文链接: