化疗在肿瘤治疗中有着举足轻重的地位,但是化疗缺乏特异性,容易对正常细胞及组织造成伤害,引起严重的副作用;而且肿瘤会在化疗后“进化”出耐药性,使化疗效果降低甚至消失。将化疗药物用聚合物、脂质体等载体进行负载能解决这些问题。近期,研究人员发现,聚合物除了能对药物进行负载和递送外,其中一些聚合物本身也具备一定的抗肿瘤性能,但是目前并没有关于构建这些具有广谱抗肿瘤活性聚合物的通用策略。
宿主防御肽在针对细菌、真菌及病毒的非特异性防御过程中起到重要作用,在抗肿瘤领域也有较大的潜力。与正常细胞相比,肿瘤外层细胞膜表面通常高表达一些荷负电的物质以及胆固醇的缺失和恶性肿瘤细胞表面微绒毛数量的增加(分别会造成细胞膜流动性和表面积的增加)会使得阳离子宿主防御肽特异性结合肿瘤细胞,并通过细胞膜溶解机制对其进行杀伤。其中,具有α螺旋构象的宿主防御肽具有更为优异的抗肿瘤活性。然而这些肽制备过程复杂,且成本高昂,于是科研人员设想是否可以利用合成的聚合物模拟这些具有抗肿瘤活性的宿主防御肽。
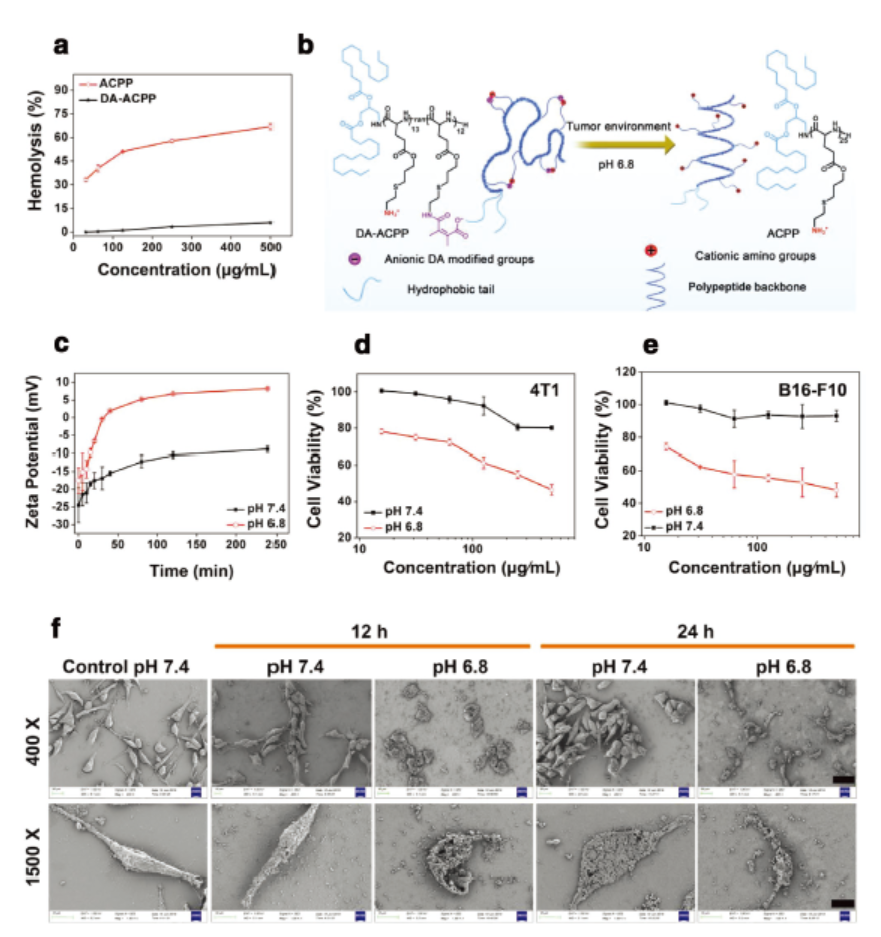
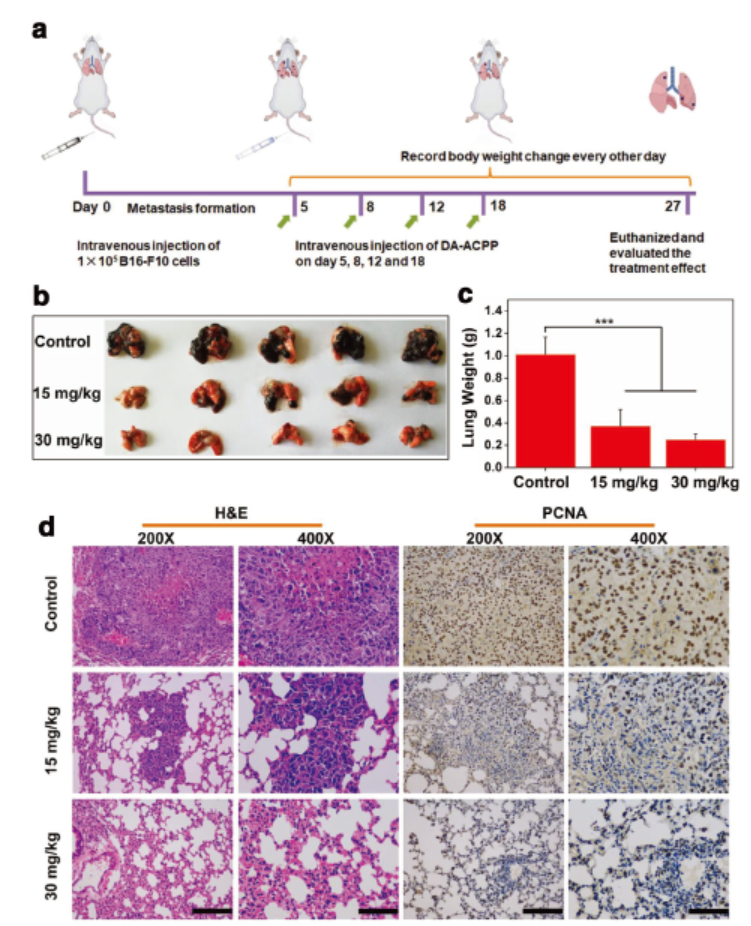
基于此,中科院长春应化所的陈学思院士和肖春生等人设计合成了一种不依赖药物而具有抗肿瘤活性的阳离子多肽(ACPP)。ACPP模拟了宿主防御肽,能够在几分钟内诱导肿瘤细胞坏死,对高达12种肿瘤细胞模型((对HeLa, 4T1, MCF-7, A549, A549/DDP,K7M2-WT, C26, CT26, B16-F10, SKOV3, PC3, PC3/DR细胞的IC50分别为30, 38, 13, 35, 35, 49, 7, 10, 41, 12, 20, 14 μg mL−1))都具有抗肿瘤活性,其中不乏耐药型和高转移型肿瘤细胞模型。为了进一步降低其对正常细胞的伤害,增大体内应用的可能性,作者对ACPP进行改性,引入pH响应基团制备两性离子DA-ACPP,在正常组织没有溶血反应,一旦到达肿瘤组织,响应肿瘤微酸环境后激活肿瘤杀伤性能,对原位乳腺癌模型和黑色素瘤肺转移模型均有很好的肿瘤抑制作用,为肿瘤治疗开辟了新道路。
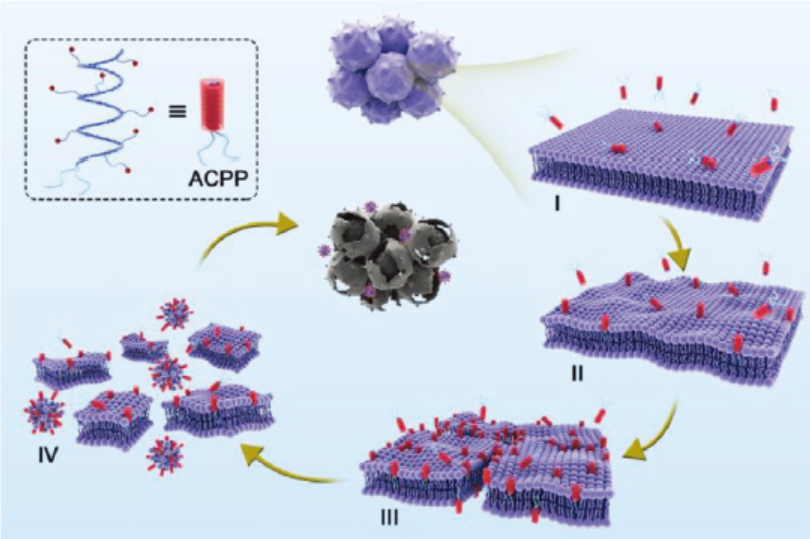
具有抗肿瘤活性的阳离子多肽的制备
作者首先利用γ-烯丙基-谷氨酸-N-羧基酸酐的开环反应以及巯基-烯点击化学制备了含有两个长碳链和侧链含伯胺的多肽。α螺旋主链和侧链一定量的氨基阳离子赋予多肽与细胞膜之间的静电相互作用并能够插入磷脂双分子层中。主链末端的两个长碳链增加多肽与肿瘤细胞膜之间的疏水相互作用。
阳离子肽通过膜溶解机制诱导肿瘤细胞坏死
作者通过肿瘤细胞形貌和结构变化验证了制备的阳离子多肽能够通过膜溶解机制诱导肿瘤细胞快速坏死。与ACPP孵育后,肿瘤细胞出现异常膜结构,包括起泡、出芽和孔隙形成。最后,微绒毛和主轴形状消失,膜结构坍塌破碎。同时,肿瘤细胞膜完整性和渗透性的改变进一步证明ACPP的膜溶解机制。ACPP对高达12种肿瘤细胞模型都具有抗肿瘤活性,其中不乏耐药型和高转移型肿瘤细胞模型。
对阳离子肽进行改性增加生物安全性并增加体内实验的可行性
ACPP虽然对肿瘤细胞有较好的杀伤能力,但其正电性容易造成溶血,不适合进行体内实验。为了增加阳离子多肽的生物安全性,作者对多肽进行改性,将阳离子氨基通过pH响应的酸酐变成荷负电的羧基,得到两性离子DA-ACPP。两性离子减少了正常细胞对它摄取,降低副作用。当响应肿瘤微环环境后,DA-ACPP被激活成ACPP,实现高效的抗肿瘤性能。
最后,作者选择两个肿瘤模型:4T1原位乳腺癌肿瘤和B16-F10黑色素瘤肺转移模型进行了DA-ACPP抗肿瘤活性的体内实验。经过DA-ACPP治疗的小鼠肿瘤体积和质量最小,肿瘤组织染色出现明显坏死,并且对肺转移肿瘤也有一定抑制作用。
原文链接:


