多伦多大学的Warren C. W. Chan团队致力于提高药物向肿瘤的递送效率,2020年初,他们探讨了纳米颗粒的肿瘤渗透现象,并对纳米粒子进入实体肿瘤的机制提出了质疑,公认的EPR效应并不能很好解释纳米药物在肿瘤部位的富集现象,而转胞吞作用可能是主要机制。他们提倡要进行基础研究,正所谓大道至简。近期,他们又在Nature Materials刊文,发现给药剂量阈值在提高纳米药物向肿瘤的递送效率起到关键作用,论文题目为“The dose threshold for nanoparticle tumour delivery”。通过简单的提高纳米药物剂量就能实现更多的肿瘤富集和更好的治疗效果。
纳米药物的发展为肿瘤治疗带来了不可估量的前景,但是目前只有十种纳米药物通过了FDA的审批。研究表明,只有0.7%的纳米药物能够到达肿瘤部位,这极低的递送效率无疑阻碍了纳米药物的临床发展。传统的对纳米药物的尺寸、形貌、表面化学等的调控也只能有限的提高递送效率,因此,很需要发展一种通用的方法有效提高纳米药物向肿瘤的递送效率。
Warren C. W. Chan团队发现纳米药物递送存在剂量阈值,必须打破这个剂量阈值才能实现可预测的、有效的药物递送。这个阈值存在于Kupffer细胞吸收纳米颗粒的动力学极限,而不是它们的总容量。
肝脏清除的剂量阈值
肝脏是最大的网状内皮系统(RES)器官,在治疗过程种会摄取大量的纳米药物并将其清除。作者假设,一旦给药剂量超过Kupffer细胞对纳米药物的最大摄取速率,那么被肝脏摄取的纳米药物的比例将会降低。于是作者给长瘤的小鼠注射剂量跨越三个数量级(500亿到50万亿)的纳米药物,发现增加给药剂量能明显延长纳米药物的血液半衰期(2 min增加到8 h),说明高剂量药物能明显降低肝脏清除效率。

为了探究潜在的剂量阈值,作者研究了肝细胞能够摄取24 h以上的纳米粒子的数量。他们发现,这个阈值不是由于Kupffer细胞死亡(研究的剂量范围内没有观察到肝细胞毒性),并且与加速血液清除率现象无关。在24小时内,超过1万亿纳米颗粒的单次剂量,Kupffer细胞的摄取基本上受到限制。
剂量阈值在Kupffer细胞中的作用机制
给药30 min后的活体成像表明,巨噬细胞的摄取能力并未达到饱和,这与之前研究的网状内皮系统阻断(假设必须通过治疗前注射使容量饱和,以减少第二剂量治疗性纳米药物的清除)相反,大量超过阈值的纳米药物通过超越Kupffer细胞摄取速率而不是摄取能力而影响肝脏清除。
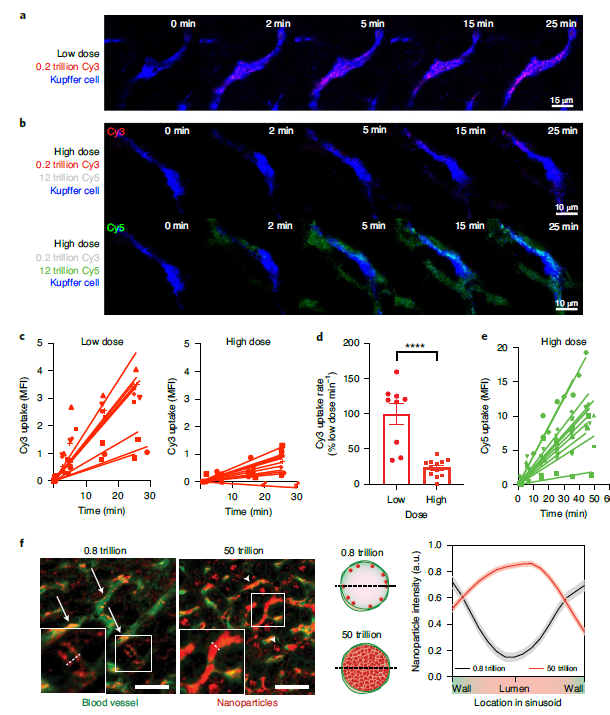
随后,作者研究了三个通用的Kupffer细胞的摄取通路(网格蛋白和小窝蛋白介导的内吞作用、大胞饮作用和受体介导的吞噬作用)以理解高于阈值的给药剂量是如何超越摄取速率的。作者首先排除了小泡或网格蛋白介导的内吞作用,因为这些小泡在Kupffer细胞中通常不会摄取大于35 nm的粒子。然后通过与大胞饮标记物右旋糖苷的荧光对比,也排除了大胞饮过程。因此作者猜测Kupffer细胞摄取纳米粒子是通过受体介导的吞噬作用。注射纳米粒子15 min后,低剂量的纳米粒子只能勾勒出轮廓,而高剂量注射的纳米粒子集中分布在管腔内,表明高剂量给药影响了受体和血窦壁的结合位点。作者总结,纳米粒子的剂量阈值与Kupffer细胞上可用受体的数量和结合位点有关。具体的受体在未来的工作种仍有待确定。超过这个有效结合位点阈值的剂量会使Kupffer细胞的吸收速率过大,肝脏清除率降低,循环时间延长。
超过阈值的肿瘤递送
然后作者研究了肿瘤递送效率和纳米粒子个数的关系,以评估剂量阈值,并确定超过该阈值的给药特性。实验发现,增加纳米粒子给药剂量,向肿瘤递送的粒子明显增多,肝脏富集相应降低。作者还比较了高于阈值的单次剂量与低于阈值的多剂量给药(总给药量相同)的生物分布,以测试这种效应是否会累积。结果表明,尽管两组纳米粒子总数相同,但单次大剂量给药的肝脏蓄积减少,循环半衰期增加,肿瘤释放量增加。肿瘤递送效率在最低注射剂量时为0.03%,在最高剂量时为12%。这与高剂量纳米粒子超过肝脏摄取速率而不是绝对摄取能力的原则是一致的。这些结果证实了单次注射超过1万亿纳米粒子的阈值可以改善肿瘤的传递。
作者对于研究者这么晚才发现给药剂量阈值这一概念感到十分惊讶,毕竟给药效率在治疗过程中式如此重要。这可能也源于研究者普遍只报道了低剂量给药。在典型的纳米粒子尺寸依赖性研究中,剂量被归一化到表面积或质量,这导致了更小的纳米粒子数量的增加。当我们以表面积或质量为单位对剂量进行归一化时,阈值变得模糊,剂量与肿瘤递送的相关性显著下降,肿瘤和肝脏中出现了大小依赖的积累。这表明纳米粒子的剂量在大小依赖研究中可能是一个混杂变量,它被归一化指标的选择所隐藏。而按纳米粒子数量计算的剂量可能比纳米粒子大小更合适。
肿瘤细胞传递超过阈值剂量
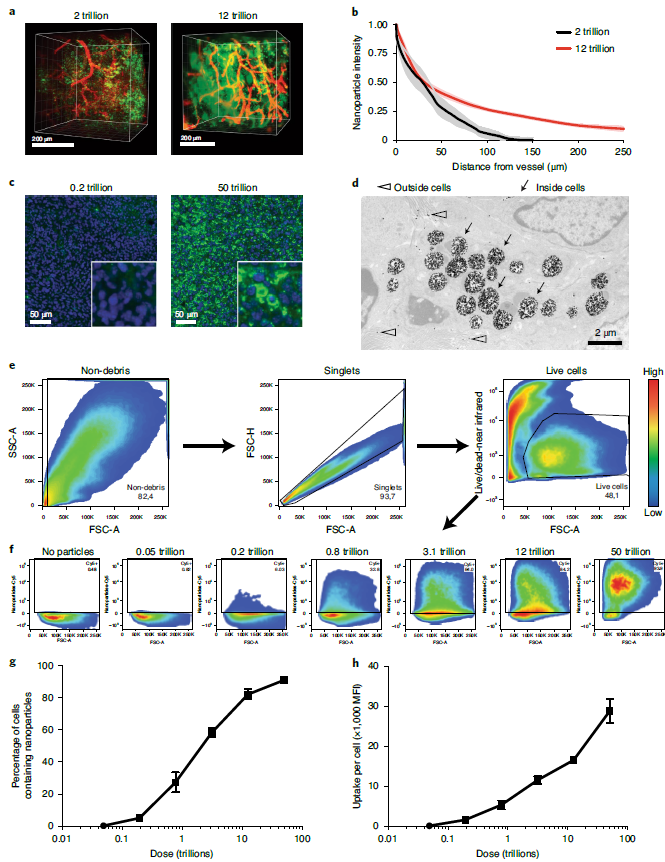
作者还研究了增加剂量和递送对肿瘤中纳米粒子与细胞相互作用的影响。药物向细胞的不完全递送是一个普遍的局限性,原因之一是药物很难在远端扩散。作者假设,更高的递送效率会导致肿瘤中更大的纳米颗粒子浓度梯度,从而最终促进更多的细胞相互作用。于是作者对靠近血管的纳米粒子进行成像,观察到超过万亿阈值的高剂量的纳米粒子分布在更远的血管和更深的肿瘤组织中,并且93%的肝脏细胞都摄取了高剂量纳米粒子。而低于阈值的纳米粒子(0.2万亿)稀疏地分布在肿瘤组织中,只有0.7%的细胞将其内化。
高于给药阈值提高治疗效果
为了解决纳米粒子数量与药物剂量之间的关系,作者选择良性填充纳米粒子增加纳米粒子数量,而不增加活性药物的剂量。他们比较了两个接受相同剂量的治疗性纳米粒子的4T1荷瘤小鼠组,但实验组同时接受额外剂量的给药增强剂。两组小鼠都接受了超过1万亿的纳米颗粒,以确保显著的剂量依赖性。实验发现,实验小鼠的阿霉素血清和肿瘤水平更高,阳性细胞核数量更多,肿瘤体积减小57%,生存期延长29%,治疗效果明显优于对照组。
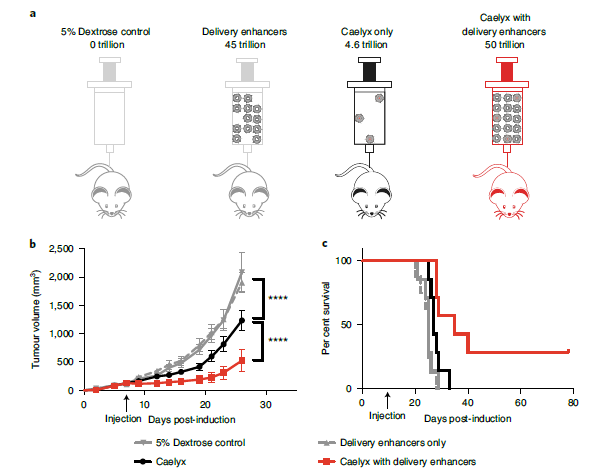
同时作者还发现,Kupffer细胞是一个异质性群体,每个细胞清除特定的纳米粒子类型。剂量阈值原理比网状内皮系统阻断技术更有效。总的来说,纳米粒子的剂量超过阈值直接提高治疗效果,而不依赖于活性药物的剂量。
1万亿的阈值在所有文献中都存在
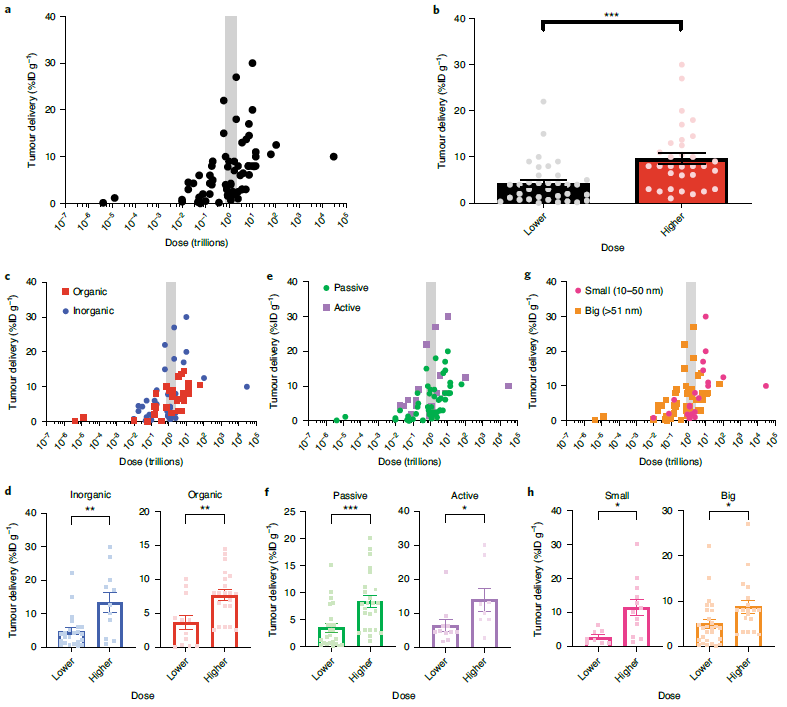
作者在40份出版物中成功地按粒子数重新计算了纳米颗粒的剂量,获得了67个总剂量和给药数据点,发现按纳米粒子数计算的剂量与给药量相关。这些论文中使用的中位剂量是1.2万亿纳米粒子,接近实验中观察到的1万亿阈值。高于该阈值剂量的文献明显多于低于该阈值剂量的文献。作者进一步将这些数据分为无机和有机、被动和主动、小(≤50纳米)和大(>50纳米)纳米粒子,并观察到该阈值在所有亚类都持续存在。这些结果强调了按数量计算的纳米粒子剂量与肿瘤给药之间的关系是重要的,但迄今为止,尚未实现。作者也敦促科研人员考虑使用高于阈值剂量的纳米粒子进行给药。
临床纳米药物的探讨
目前用于人体的纳米颗粒给药标准与小分子药物相同,根据活性药物的量分配剂量。例如,Caelyx的推荐剂量是每平方米50毫克阿霉素,而没有提及纳米粒子的当量剂量。纳米粒子或活性药物成分的适当度量是有争议的。根据质量推断,并假设Kupffer细胞密度和活性与小鼠相似,人类纳米粒子的剂量应该超过1500万亿纳米颗粒的阈值才能实现有效的肿瘤递送。Caelyx、Myocet和Onivyde等成功的临床纳米粒子的典型剂量超过了这一阈值,分别达到8.6、1.7和1.9万亿。
小结
作者发现了一种纳米粒子数目阈值剂量,可以改善纳米颗粒给药和治疗。1万亿纳米粒子的一般阈值使肝脏不堪重负,并在小鼠身上将注射剂量的12%最大化到肿瘤。这一特定值可能因纳米粒子设计和体内种类而异,但它形成了大于1万亿纳米粒子的基本剂量阈值概念。目前临床批准的抗肿瘤纳米粒子制剂,如Caelyx/Doxil,可以采用增强递送策略提高对实体肿瘤的治疗效果。广泛而仔细地评估纳米粒子剂量与这一阈值,将提供一种强大的、通用的和简单的方法,以推进新一代的给药策略,成像、诊断和治疗。
原文链接:



